
【题目】2000年一家制药公司首次在网站上悬赏下列化合物的合成路线,悬赏金额为$100000.该化合物的结构如图1:试回答下列问题: 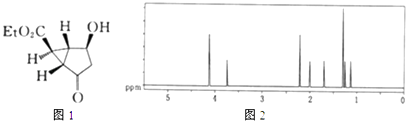
(1)上述结构式中Et表示乙基,该分子的化学式为 . 有机物归类时,母体优先顺序为酯>酸>醛(或酮)>醇等,则该分子所属类别是 .
(2)解决有机分子结构问题的手段之一是核磁共振.图2是计算机软件模拟出的该分子氢原子的核磁共振波谱图.氢原子在分子中的化学环境(原子之间相互作用)不同,其峰线在核磁共振谱图中就处于不同的位置;化学环境相同的氢原子越多,峰线的强度(高度)越大. 试参考该分子的结构简式分析谱图:该分子中共有种化学环境不同的氢原子;谱线最高者表示有个化学环境相同的氢原子;谱线最低者表示有个化学环境相同的氢原子.
科目:高中化学 来源: 题型:
【题目】元素A、B、C都是短周期元素,A元素原子的2p轨道上只有两个未成对电子,B的3p轨道上有空轨道,A、B同主族,B、C同周期,C是本周期中电负性最大的.请回答:
(1)A原子的核外电子排布图 , B原子的核外电子排布式 , C原子的价电子排布式 .
(2)A,B,C的气态氢化物的化学式分别是 , 其中最不稳定的是 .
(3)它们的最高价氧化物的水化物中,酸性最强的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜器久置,表面会生成一层绿色固体,为了解铜在空气中的腐蚀情况,某化学兴趣小组收集家中铜器表面的绿色固体进行探究.查阅相关资料后,猜想该绿色物质可能是铜的碳酸盐. 该小组同学利用如图装置进行实验.
①对试管内的绿色固体进行加热,至完全分解,观察到A装置中绿色固体逐渐变成黑色,B装置中无水硫酸铜变成蓝色,C装置中澄清石灰水变浑浊.
②取少量加热后生成的黑色固体于试管中,加入稀硫酸.观察到黑色固体逐渐溶解,溶液变成蓝色.
③取少量上述蓝色溶液加入试管中,浸入一根洁净的铁丝.观察到铁丝表面有红色物质析出.
请回答下列问题:
(1)绿色固体中含有的元素是 .
(2)加热后试管中剩余的黑色物质是 .
(3)假设该绿色物质是一种纯净物,则其化学式可能是 , 加热分解的化学方程式为 .
(4)上述实验步骤③中的反应的离子方程式为 .
(5)实验装置最后的干燥管的作用是 .
(6)如果将B、C两装置对调,能否达到实验目的? , 为什么? .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氢化钾(KH)属于离子化合物,KH跟水反应可以放出氢气.下列说法中正确的是( )
A.KH的水溶液呈碱性
B.KH中氢离子可以被还原为氢气
C.KH是一种强氧化剂
D.KH中的氢离子是裸露的质子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定酸碱反应的中和反应反应热,计算时至少需要的数据是( ) ①酸的浓度和体积
②碱的浓度和体积
③比热容
④反应后溶液的质量
⑤生成水的物质的量
⑥反应前后溶液温度变化
⑦操作所需的时间.
A.①②③⑥
B.①③④⑥
C.③④⑤⑥
D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现如图所示的物质之间的变化:

回答下列问题:
(1)写出所含物质的化学式:固体B_____,沉淀D_____。
(2)写出①、④两个反应的化学方程式:
①_______________________________________
④_______________________________________
(3)写出②、③两个反应的离子方程式:
②_______________________________________
③_____________________________________
(4)设计实验检验溶液F中所含溶质的阳离子:___________________________。
(5)分别写出Al2O3和Fe2O3在工业上的一种主要用途:
Al2O3︰_____________________________________
Fe2O3︰_____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.NH3、CO,CO2都是极性分子
B.CH4、CCl4都是含有极性键的非极性分子
C.HF,HCl、HBr、HI的稳定性依次增强
D.CS2、H2O,C2H2都是直线形分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某Na2O2 固体中因吸收CO2 而含有少量Na2CO3,经实验测定样品中Na2O2的质量分数为88.0%。现称取该样品8.86g,加入水充分反应后放出气体,所得溶液体积为500mL。试计算:(要求:写出解题过程,计算结果保留两位小数)
(1)上述反应所得气体在标准状况下的体积;_________
(2)反应后溶液中Na+的物质的量浓度。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)某温度下,在Ca(OH)2(Ksp=5.5×10﹣6)、Mg(OH)2(Ksp=3.2×10﹣11)、AgCl(Ksp=1.8×10﹣10)三种物质中,溶解度最小的是
(2)在粗制CuSO45H2O晶体中常含有杂质Fe2+ . 在提纯时为了除去Fe2+ , 常加入氧化剂,使Fe2+氧化为Fe3+ , 下列物质最合适的是 A.KMnO4 B.H2O2 C.Cl2 水 D.HNO3
已知KMnO4氧化Fe2+时,生成Mn2+离子,试写出酸性KMnO4与Fe2+反应的离子反应方程式;然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3 , 可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的
A.NaOH B. NH3H2O C.CuCO3 D.Cu(OH)2
(3)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10﹣38 , Cu(OH)2的溶度积Ksp=3.0×10﹣18 , 通常认为残留在溶液中的离子浓度小于1×10﹣5 molL﹣1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0molL﹣1 , 则Cu(OH)2开始沉淀时溶液的pH为 , Fe3+完全沉淀时溶液的pH为(已知lg2=0.3,lg5=0.7),通过计算确定上述方案(填“可行”或“不可行”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com