
| 电解质 | a.HF | b.HNO2 | c.HCN | d.NH3?H20 | e.H2S |
| 电离平衡常数 | 7.2×10-4 | 4.6×10-10 | 4.9×10-10 | 1.8×10-5 | k1=9.1×10-8 k2=1.1×10-12 |
| C(H+).C(A-) |
| C(HA) |
| 0.01mol |
| 0.5L |
| C(H+).C(A-) |
| C(HA) |
| 0.02×0.02 |
| 0.2-0.02 |


科目:高中化学 来源: 题型:
| A、加热情况下 |
| B、加压条件下 |
| C、通直流电情况下 |
| D、常温常压下 |
查看答案和解析>>
科目:高中化学 来源: 题型:
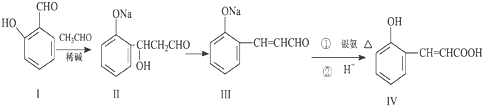
查看答案和解析>>
科目:高中化学 来源: 题型:
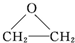 是原子利用率为100%的转化.下列对X的推断中不正确的是( )
是原子利用率为100%的转化.下列对X的推断中不正确的是( )| A、可使酸性KMnO4溶液褪色 |
| B、可使溴水褪色 |
| C、一定条件下,可用H2除去乙烷中的X |
| D、与丙烯互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应NH3(g)+HCl(g)=NH4Cl(s)低温下能自发进行,说明该反应的△H<0 |
| B、常温下,将醋酸稀溶液加水稀释,溶液中c(H+)/c(CH3COOH)增大 |
| C、铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 |
| D、Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1:1 |
| B、1:1:2 |
| C、1:2:1 |
| D、4:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、肯定没有Cl2和HCl |
| B、CO和H2中至少有一种 |
| C、不能确定有无HCl、SO2 |
| D、肯定有SO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com