
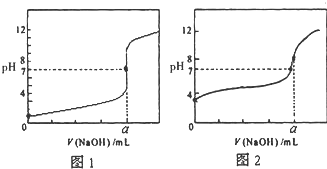
 今有常温条件下A、B、C三种溶液,A为0.01mol?L-1的HCl溶液,B为0.01mol?L-1的CH3COOH溶液,C为0.01mol?L-1的NaOH溶液,回答下列问题:
今有常温条件下A、B、C三种溶液,A为0.01mol?L-1的HCl溶液,B为0.01mol?L-1的CH3COOH溶液,C为0.01mol?L-1的NaOH溶液,回答下列问题:| [CH3COO-]?[H+] |
| [CH3COOH] |
| [CH3COO-]?[H+] |
| [CH3COOH] |
| [CH3COO-]?[H+] |
| [CH3COOH] |


 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
| A、1:1 | B、6:1 |
| C、1:6 | D、4:27 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定含甲烷,不含乙烷 |
| B、一定含乙烷,不含甲烷 |
| C、一定是甲烷和乙烯的混合物 |
| D、一定含甲烷,但不含乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | +6、-2 | +5、-3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.102 | 0.110 | 0.143 | 0.160 | 0.186 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A、C两元素处在元素周期表中的第ⅥA族 |
| B、C、D两种元素的最高价氧化物的水化物相互能够反应生成一种强电解质 |
| C、B、D两元素组成的化合物中阴、阳离子的个数比为1:1 |
| D、B、C、D三种元素的简单离子的半径大小顺序为:C>D>B |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入足量的新制氯水,溶液颜色变深,则含有Br- |
| B、加入KMnO4酸性溶液,溶液颜色褪去,则含有Br- |
| C、加入少量的碘水,再加入CCl4振荡,CCl4层有色,则含有Br- |
| D、加入足量FeCl3溶液,用CCl4萃取后,在无色的水层中加入氯水,溶液呈橙黄色,则含有Br- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com