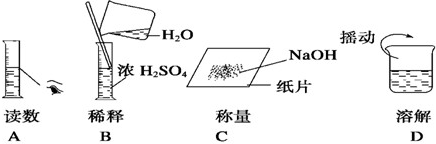
解:(1)使用研钵将晶块研碎;
故答案为:研钵;
(2)加热时固体飞溅出来,剩余固体的质量偏小,测定水的质量偏高,故测定n值偏高,
托盘天平精确到0.1,故当两次称量的质量差不超过0.1g时,可认为加热至恒重,完全脱水;
故答案为:高,两次称量质量差不超过0.1 g;
(3)为防止固体吸收空气中的水而重新生成结晶水合物,应在干燥管中冷却,注意用坩埚钳夹持,
故答案为:用坩埚钳把坩埚移到干燥器中冷却;
(4)检验样品的纯度,可加入氯化钡溶液,根据生成硫酸钡的质量测定样品的纯度,判断溶液是否足量的方法是静置后向上层清液滴加适量A观察有无沉淀产生,说明已经足量;
故答案为:BaCl
2(其它试剂只要合理也可以);静置后向上层清液滴加适量A观察有无沉淀产生;
(5)洗涤沉淀的方法是:用玻璃棒引流加入蒸馏水至浸没过沉淀物,待水流完后重复以上操作至洗净为止;
故答案为:用玻璃棒引流加入蒸馏水至浸没过沉淀物,待水流完后重复以上操作至洗净为止;
(6)干燥后生成硫酸钡的质量为m
2g,则硫酸钡的物质的量为
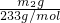
=
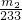
mol,则KAl(SO
4)
2?12H
2O的质量为
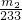
mol×

×474g/moL=

g,所以明矾的纯度为
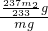
×100%=

%;
故答案为:

.
分析:(1)使用研钵将晶块研碎;
(2)加热时固体飞溅出来,剩余固体的质量偏小,测定水的质量偏高,
托盘天平精确到0.1,故当两次称量的质量差不超过0.1g时,可认为加热至恒重,完全脱水;
(3)为防止固体吸收空气中的水而重新生成结晶水合物,应在干燥管中冷却;
(4)由流程图可知,检验样品的纯度,可加入氯化钡溶液,根据生成硫酸钡的质量测定样品的纯度;
判断溶液是否足量的方法是静置给上层清液滴加适量A观察有无沉淀产生,说明已经足量;
(5)洗涤沉淀的方法是:用玻璃棒引流加入蒸馏水至浸没过沉淀物,待水流完后重复以上操作至洗净为止;
(6)根据生成硫酸钡的质量计算明矾的质量,从而计算样品的纯度.
点评:本题考查物质的组成和含量的测定,题目较难,本题注意实验的原理和操作方法的注意事项,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.

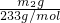 =
=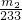 mol,则KAl(SO4)2?12H2O的质量为
mol,则KAl(SO4)2?12H2O的质量为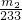 mol×
mol× ×474g/moL=
×474g/moL= g,所以明矾的纯度为
g,所以明矾的纯度为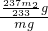 ×100%=
×100%= %;
%; .
.

 全能测控一本好卷系列答案
全能测控一本好卷系列答案