
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是__________________。(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol·L-1 NH4Al(SO4)2中c(NH4+)________(填“等于”“大于”或“小于”)0.1 mol·L-1 NH4HSO4中c(NH4+)。
(3)0.1 mol·L-1电解质溶液的pH随温度变化的图像如图所示:
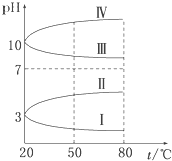
①其中符合0.1 mol·L-1 NH4Al(SO4)2的pH随温度变化的曲线是________(填写序号),导致pH随温度变化的原因是__________________;
②20℃时,0.1mol·L-1NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=________(填数值)。
【答案】Al3+水解生成的Al(OH)3具有吸附性,即Al3++3H2O![]() Al(OH)3(胶体)+3H+,Al(OH)3吸附悬浮颗粒使其沉降从而净化水 小于 Ⅰ NH4Al(SO4)2水解,溶液呈酸性,升高温度,其水解程度增大,pH减小 10-3 mol·L-1
Al(OH)3(胶体)+3H+,Al(OH)3吸附悬浮颗粒使其沉降从而净化水 小于 Ⅰ NH4Al(SO4)2水解,溶液呈酸性,升高温度,其水解程度增大,pH减小 10-3 mol·L-1
【解析】
(1)Al3+水解生成的Al(OH)3胶体,具有吸附性;
(2)NH4Al(SO4)2中Al3+水解呈酸性抑制NH4+水解,HSO4-电离出H+同样抑制NH4+水解;
(3)①NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大;
②根据电荷守恒定律解题.
(1)Al3+水解生成的Al(OH)3胶体,具有吸附性,离子方程式:Al3++3H2O═Al(OH)3 (胶体)+3H+,Al(OH)3吸附悬浮颗粒使其沉降从而净化水;
(2)NH4Al(SO4)2与NH4HSO4中的NH4+均发生水解,但是NH4Al(SO4)2中Al3+水解呈酸性抑制NH4+水解,HSO4-电离出H+同样抑制NH4+水解,因为HSO4-电离生成的H+浓度比Al3+水解生成的H+浓度大,所以NH4HSO4中NH4+水解程度比NH4Al(SO4)2中的小,故填:小于;
(3)①NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大,pH减小,符合的曲线为Ⅰ;
②根据电荷守恒,可以求出2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+)-c(OH-)=10-3 mol·L-1[c(OH-)太小,可忽略].


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】将锌片、铜片用导线连接后,置于稀硫酸中,形成原电池,如图所示:
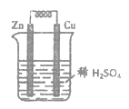
负极是___;负极反应式:___;铜片质量___(选填:增加、不变、减少);其正极反应式:___;在导线中e-流动方向是___→___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则 ( )
2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则 ( )
A. 平衡不移动
B. 再达平衡时,n(A)∶n(B)∶n(C)仍为2∶2∶1
C. 再达平衡时,C的体积分数增大
D. 再达平衡时,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 0.1000 mol/L NaOH溶液滴定 20.00mL 0.1000 mol/L CH3COOH溶液所得滴
定曲线如图。下列说法不正确的是

A. a点所示溶液中:c(Na+)=c(CH3COOH) + c(CH3COO-)
B. b和c点所示溶液中:c(OH-)-c(H+)=c(Na+)-c(CH3COO-)
C. d点所示溶液中:c(Na+) >c(CH3COO-) >c(OH-) >c(H+)
D. 滴定过程中可能出现:c(CH3COOH) >c(CH3COO-) >c(H+)> c(Na+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.工业上利用二氧化硅和焦炭在高温下反应制得单质硅和二氧化碳的原理制取粗硅
B.海水是一个巨大的宝藏,氯、溴、碘、硫、钠、钾等重要元素主要来自于海水
C.工业上利用![]() 和
和![]() 光照下反应生成HCl,再将其溶于水生产盐酸
光照下反应生成HCl,再将其溶于水生产盐酸
D.高炉炼铁得到的铁是含碳![]() 的生铁,通过炼制生铁可以得到用途更广泛的钢,钢的含碳量比生铁低
的生铁,通过炼制生铁可以得到用途更广泛的钢,钢的含碳量比生铁低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.浓硫酸与铁加热反应后,铁片有剩余,生成的气体除水蒸气外为![]()
B.用干燥且洁净的玻璃棒蘸取NaClO溶液,滴到放在表面皿上的pH试纸上测pH值
C.工业上电解熔融氯化铝可得到金属铝
D.使用滴定管时水洗后需润洗,但容量瓶水洗后不用润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不属于可逆反应的是( )
A.氯气与水反应生成HCl与HClO
B.N2与H2在一定条件下可以生成NH3,同时NH3又可分解为N2和H2
C.电解水生成H2和O2,氢气和氧气燃烧生成H2O
D.SO2溶于水生成H2SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为_____、_____(填标号)。
A.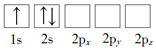 B.
B.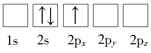
C.![]() D.
D.![]()
(2)Li+与H具有相同的电子构型,r(Li+)小于r(H),原因是______。
(3)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是______、中心原子的杂化形式为______。LiAlH4中,存在_____(填标号)。
A.离子键 B.σ键 C.π键 D.氢键
(4)Li2O是离子晶体,其晶格能可通过图(a)的BornHaber循环计算得到。
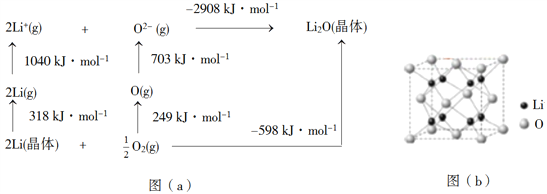
可知,Li原子的第一电离能为________kJ·mol1,O=O键键能为______kJ·mol1,Li2O晶格能为______kJ·mol1。
(5)Li2O具有反萤石结构,晶胞如图(b)所示。已知晶胞参数为0.4665 nm,阿伏加德罗常数的值为NA,则Li2O的密度为______g·cm3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积2L的密闭容器中加入反应物N2、H2,发生如下反应:N2(g)+3H2(g)![]() 2NH3(g)。反应过程中的部分数据如下表所示,下列说法正确的是
2NH3(g)。反应过程中的部分数据如下表所示,下列说法正确的是
物质的量/ mol 时间/min | n(N2) | n(H2) | n(NH3) |
0 | 1.0 | 1.2 | 0 |
2 | 0.9 | ||
4 | 0.75 | ||
6 | 0.3 |
A. 0~2 min内,NH3的反应速率为0.1 mol·Lˉ1·minˉ1
B. 2 min时, H2的物质的量0.3 mol
C. 4 min时,反应已达到平衡状态,此时正、逆反应的速率都为0
D. 4~6 min内,容器内气体分子的总物质的量不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com