
| m |
| M |
| 1.43×103g |
| 143g/mol |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、①②④⑤⑦⑧ |
| B、①③⑤⑧⑨ |
| C、①②③⑤⑥⑦ |
| D、③⑤⑦⑧⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 |
| B、0.1 mol/L的Na2S溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) |
| C、含有NH4+、Cl-、H+、OH-的溶液中,其离子浓度一定是:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
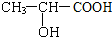
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验内容 | 实验目的 |
| A | 使用100mL的量筒量取一定体积的液体 | 准确量取9.4mL盐酸 |
| B | 用石墨做电极电解等物质的量浓度的NaX和NaY的混合溶液 | 比较X-、Y-的还原性强弱 |
| C | 往浸过火柴头(一般是KClO3、MnO2、S等)的溶液中加AgNO3溶液和稀硝酸 | 检验火柴头中含氯元素 |
| D | 将NH4Cl固体加热分解 | 制取HCl和NH3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制标准溶液时,固NaOH体中混有NaCl 杂质 |
| B、滴定终点读数时,俯视滴定管的刻度 |
| C、盛放未知液的锥形瓶用蒸馏水洗过,未用未知液体润洗 |
| D、配制NaOH标准溶液时,定容时俯视刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KMnO4,H2SO4,AlCl3 |
| B、NaClO,MgCl2,HNO3 |
| C、NaCl,NaClO4,NaClO3,Na2SO4 |
| D、KClO3,KCl,H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com