
【题目】聚苯乙烯塑料在生产中有广泛应用。工业中以乙苯(![]() )为原料制取装乙烯(
)为原料制取装乙烯(![]() )的主要途径有
)的主要途径有
①催化脱氢

②氧化脱氢

③和二氧化碳催化脱氢

(1)苯乙烯在一定条件下合成聚苯乙烯的化学方程式为___________。
(2)根据上述信息,能否计算出CO的燃烧热?若不能计算,该空不用作答;若能计算,请写岀CO的燃烧热△H为___________。
(3)某企业以反应①生产苯乙烯。某同学认为:向反应体系①中通入适量的O2,能增加乙苯的转化率,该同学作出判断的依据可能是___________。
(4)在温度为T时,在2L的密闭容器中加入2mol乙苯和2mol二氧化碳,反应到平衡时测得混合物各组成的物质的量均为1.0mol。
①若保持温度和容器容积不变,向该容器中再充入2mol乙苯和2mol二氧化碳达到平衡时,则乙苯的物质的量浓度___________。
A.等于1mol·L-1 B.小于1mol·L-1 C.大于1mol·L-1 D.不确定
②若将反应改为恒压绝热条件下进行,达到平衡时,则乙苯的物质的量浓度___________。
A.等于0.5mol·L-1 B.小于0.5mol·L-1 C.大于0.5mol·L-1 D.不确定
(5)温度为T时,在恒容容器中进行上述“①催化脱氢”反应。已知:乙苯的起始浓度为1.0mol·L-1;设起始时总压强为a,平衡时总压强为b,达到平衡时需要的时间为tmin则从反应开始到平衡的过程中苯乙烯的平均反应速率为___________(用代数式表示,下同);该温度下的化学平衡常数为___________。
【答案】 -275.6kJ.mol-1 因为在高温下,O2会将反应中生成的H2消耗掉,减小了H2的浓度,同时反应放出的热量使休系温度升高,这两种因素均使平衡向正反应方向移动 C D
-275.6kJ.mol-1 因为在高温下,O2会将反应中生成的H2消耗掉,减小了H2的浓度,同时反应放出的热量使休系温度升高,这两种因素均使平衡向正反应方向移动 C D ![]() mol
mol![]() L-1 . min-1 (b-a)2/a(2a-b)mol·L-1
L-1 . min-1 (b-a)2/a(2a-b)mol·L-1
【解析】
(2)根据盖斯定律计算;(3)依据外界条件对平衡状态的影响分析。(4)①同等比例的增大反应物的量.相当于增大压强,对正反应气体分子数目增大的反应而言,乙苯的转化率减小,即再一次平衡时乙苯的物质的量大于2mol;②上述恒容容器中进行反应,气体压强增大,要将该反应在恒压条件下进行,相当于恒容条件下平衡状态减压达到新平衡,在平衡之后减压,平衡向正方向移动(正方向是气体分子数增大的方向),乙苯的物质的量浓度减小;又由于正反应是吸热反应,在绝热容器中,与外界没有能量交换,平衡向正方向移动,吸收热量会增多,容器内反应体系的温度会降低,平衡会向左移动,乙苯的浓度减小。二者使平衡移动方向不同且移动程度不确定,最终乙苯的浓度增大、减小或不变都有可能。
(1)苯乙烯在一定条件下合成聚苯乙烯的化学方程式为 。
。
(2)根据盖斯定律,②减去③可得:CO(g)+1/2O2(g)=CO2 (g)△H =-275.6kJ.mol-1 ,所以CO的燃烧热△H为-275.6kJ.mol-1;
(3)根据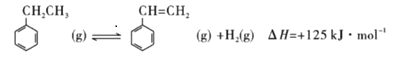 可知在高温下,通入O2会将反应中生成的H2消耗掉,减小了H2的浓度,同时氢气和氧气反应放出的热量使休系温度升高,这两种因素均使平衡向正反应方向移动。答案:通入O2会将反应中生成的H2消耗掉,减小了H2的浓度,同时氢气和氧气反应放出的热量使休系温度升高,这两种因素均使平衡向正反应方向移动。
可知在高温下,通入O2会将反应中生成的H2消耗掉,减小了H2的浓度,同时氢气和氧气反应放出的热量使休系温度升高,这两种因素均使平衡向正反应方向移动。答案:通入O2会将反应中生成的H2消耗掉,减小了H2的浓度,同时氢气和氧气反应放出的热量使休系温度升高,这两种因素均使平衡向正反应方向移动。
(4)①由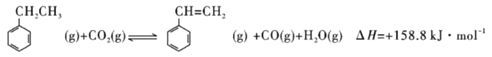 ,在温度为T时,在2L的密闭容器中加入2mol乙苯和2mol二氧化碳,反应到平衡时测得混合物各组成的物质的量均为1.0mol。同等比例的增大反应物的量.相当于增大压强,对正反应气体分子数目增大的反应而言,乙苯的转化率减小,即再一次平衡时乙苯的物质的量大于2mol, 乙苯的物质的量浓度大于1mol/L;故选C;
,在温度为T时,在2L的密闭容器中加入2mol乙苯和2mol二氧化碳,反应到平衡时测得混合物各组成的物质的量均为1.0mol。同等比例的增大反应物的量.相当于增大压强,对正反应气体分子数目增大的反应而言,乙苯的转化率减小,即再一次平衡时乙苯的物质的量大于2mol, 乙苯的物质的量浓度大于1mol/L;故选C;
②上述恒容容器中进行反应,气体压强增大,要将该反应在恒压条件下进行,相当于恒容条件下平衡状态减压达到新平衡,在平衡之后减压,平衡向正方向移动(正方向是气体分子数增大的方向),乙苯的物质的量浓度减小;又由于正反应是吸热反应,在绝热容器中,与外界没有能量交换,平衡向正向移动,吸收热量会增多,容器内反应体系的温度会降低,平衡会又会向左移动,乙苯的浓度减小。二者使平衡移动方向不同且移动程度不确定,最终乙苯的浓度增大、减小或不变都有可能。故答案为:D。
(5)根据三段式: 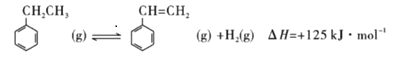
起始量(mol·L-1):1 0 0
变化量(mol·L-1) x x x
平衡量(mol·L-1)1-x x x
在相同温度相同体积的条件下,气体压强与物质的量成正比,则有;![]() ,x=
,x=![]() , 苯乙烯的平均反应速率为v=
, 苯乙烯的平均反应速率为v=![]() =
=![]() mol
mol![]() L-1·min-1;该温度下的化学平衡常数为K=
L-1·min-1;该温度下的化学平衡常数为K=![]() =(
=(![]() )2/
)2/![]() )=(b-a)2/a(2a-b).答案:
)=(b-a)2/a(2a-b).答案:![]() mol
mol![]() L-1 . min-1;(b-a)2/a(2a-b)。
L-1 . min-1;(b-a)2/a(2a-b)。


科目:高中化学 来源: 题型:
【题目】从废铅蓄电池铅膏(含PbSO4、PbO2和Pb等)中回收铅的一种工艺流程如下:

已知:浓硫酸不与PbO2反应,Ksp(PbCl2)=2.0×10-5,Ksp(PbSO4)=1.5×10-8,PbCl2(s)+2Cl-(aq)=PbCl42-(aq)。下列说法错误的是
A. 合理处理废铅蓄电池有利于资源再利用和防止重金属污染
B. 步骤①中可用浓硫酸代替浓盐酸
C. 步骤①、②、③中均涉及过滤操作
D. PbSO4(s)+2Cl-(aq)![]() PbCl2(s)+SO42-(aq)的平衡常数为7.5×10-4
PbCl2(s)+SO42-(aq)的平衡常数为7.5×10-4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有机物结构如图所示,用系统命名法命名,名称是_____;该烃的一氯代物有_____种。

(2)有机物结构如图所示,用系统命名法命名,名称是_____,将其在催化剂存在下完全氢化,所得烷烃用系统命名法命名,名称是_____。
![]()
(3)现有 CH4、C2H4、C3H4、C2H6、C3H6 五种有机物。同质量的以上物质中,在相同状况下体积最大的是_____;同质量的以上物质完全燃烧时消耗 O2 的量最多的是_____;同质量的以上物质燃烧时,生成 H2O 的量最多的是_____;同状况、同体积的以上物质完全燃烧时消耗 O2 的量最多的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)是一种重要的功能陶瓷材料以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
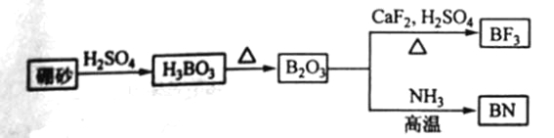
请回答下列问题:
(1) 由B2O3制备BF3、BN的化学方程式依次是_________、__________;
(2) 基态B原子的电子排布式为_________;B和N相比,电负性较大的是_________,BN中B元素的化合价为_________;
(3) 在BF3分子中,F-B-F的建角是_______,B原子的杂化轨道类型为_______,BF3和过量NaF作用可生成NaBF,BF的立体结构为_______;
(4) 在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________;
(5)六方氢化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶苞边长为361.5pm,立方氮化硼晶苞中含有______各氮原子、________各硼原子,立方氮化硼的密度是_______g·![]() (只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属氟化物一般都具有高容量、高质量密度的特点。氟离子热电池是新型电池中的一匹黑马,其结构如图所示。下列说法正确的是

A. 图示中与电子流向对应的氟离子移动方向是(B)
B. 电池放电过程中,若转移1mol电子,则M电极质量减小12g
C. 电池充电过程中阳极的电极反应式为:B+3F--3e-=BiF3
D. 该电池需要在高温条件下工作,目的是将热能转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的溶液在蒸发皿中加热蒸干并灼烧,可以得到该物质本身的是( )
①CuSO4;②KHCO3;③FeSO4;④NH4Cl;⑤MgSO4;⑥AlCl3 ;
A. ①③ B. ①⑤ C. ①③⑤ D. ①②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮和硫的化合物在工农业生产、生活中具有重要应用。请回答下列问题:
(1)航天领域中常用N2H4作为火箭发射的助燃剂。N2H4与氨气相似,是一种碱性气体,易溶于水,生成弱碱N2H4·H2O。用电离方程式表示N2H4·H2O显碱性的原因 。
(2)在恒温条件下,1 mol NO2和足量C发生反应:2NO2(g)+2C(s)![]() N2(g)+2CO2(g),测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
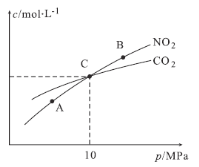
①A、B两点的浓度平衡常数关系:Kc(A) Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是 (填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp= (列出表达式并计算结果。Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)亚硝酸的电离平衡常数Ka=5.1×10-4(298K)。它的性质和硝酸很类似。
①已知298K 时,H2CO的Ka1=4.2×10-7 ;Ka2=5.61×10-11。向含有2mol碳酸钠的溶液中加入1mol的HNO2后,则溶液中CO32-、HCO3-和NO2-的离子浓度由大到小是 。
②将10mL0.1mol/L的亚硝酸溶液加入到10mL0.1mol/L氨水(已知在25℃时,一水合氨的Ki= 1.8×10-5)中,最后所得溶液为________(填“酸性”、“碱性”或者“中性”)。
(4)一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下:
①CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
②CaSO4(s)+ 4CO(g)![]() CaS(s)+ 4CO2(g) △H = -189.2kJmol-1
CaS(s)+ 4CO2(g) △H = -189.2kJmol-1
反应CaO(s)+3CO(g)+SO2(g) ![]() CaS(s)+3CO2(g) △H= kJmol-1;
CaS(s)+3CO2(g) △H= kJmol-1;
(5)H2S气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在0.10 mol·L-1H2S溶液中,通人HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图所示(忽略溶液体积的变化、H2S的挥发)。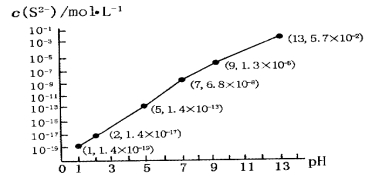
①pH=13时,溶液中的c(H2S)+c(HS-)=__________mol·L-1;
②某溶液含0.010 mol·L-1Fe2+和0.10 mol·L-1H2S,当溶液pH=______时,Fe2+开始沉淀。【已知:KSP(FeS)=1.4×10-19】
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A2+B2![]() 2AB,在温度或压强改变时,AB%的变化如图所示。a为500℃、b为300℃时的情况;c为300℃时,从t3时刻开始向容器中加压的情况。则下列叙述正确的是( )
2AB,在温度或压强改变时,AB%的变化如图所示。a为500℃、b为300℃时的情况;c为300℃时,从t3时刻开始向容器中加压的情况。则下列叙述正确的是( )

A. A2、B2、AB均为气体,正反应放热
B. AB为气体,A2、B2中最少有一种为非气体,正反应放热
C. AB为气体,A2、B2中最少有一种为非气体,正反应吸热
D. AB为液体,A2、B2中最少有一种为非气体,正反应吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含第VA族的磷、砷(As)等元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)基态P原子的核外电子排布式为____,有____个未成对电子。
(2)常温下PCl5是一种白色晶体,其立方晶系晶体结构模型如图甲所示,由A、B两种微粒构成。将其加热至148℃熔化,形成一种能导电的熔体。已知A、B两种微粒分别与CC14、SF6互为等电子体,则A为____,其中心原子杂化轨道类型为____,B为____。
(3)PO43-的空间构型为____,其等电子体有____(请写出一种)。
(4)砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%。推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措。已知砷化镓的晶胞结构如图乙,晶胞参数a= 565pm。
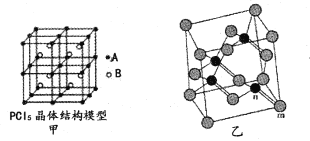
①砷化镓的化学式为____,镓原子的配位数为____。
②砷化镓的晶胞密度=____g/cm3(列式并计算,精确到小数点后两位),m位置Ga原子与n位置As原子之间的距离为____pm(列式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com