
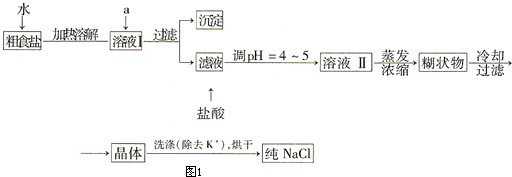
| ||
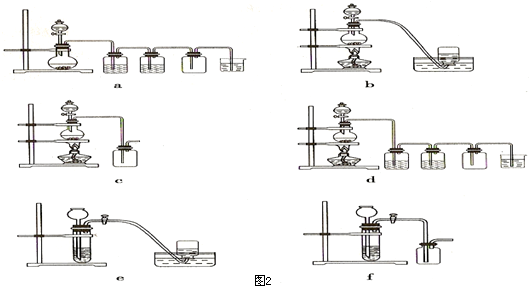
| 不加热 |
| △ |


科目:高中化学 来源: 题型:
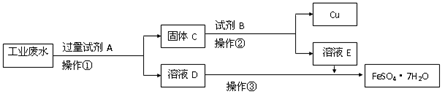 某工厂的酸性废水中含有大量的Fe3+、Cu2+、SO42-和少量Na+.为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾.
某工厂的酸性废水中含有大量的Fe3+、Cu2+、SO42-和少量Na+.为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③④ | B、①②③ |
| C、①③ | D、①② |
查看答案和解析>>
科目:高中化学 来源: 题型:
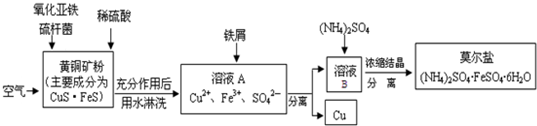
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、①⑤ | C、②③④ | D、④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 需加入的试剂 | 分离装置 | |
| 乙烷(乙烯) | ||
| 溴苯(液溴) | ||
| 苯(苯酚) | ||
| 乙醇(水) |
查看答案和解析>>
科目:高中化学 来源: 题型:
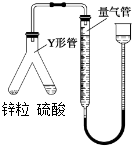
| A、实验时,将硫酸溶液倾斜倒入锌粒中 |
| B、实验时,量气管压入漏斗的水过多而溢出,不影响实验 |
| C、实验时,待体系温度降低到0℃时方可进行读数 |
| D、实验时,用CCl4代替水,测得氢气的体积更准确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、推进小火力发电站的兴建,缓解地方用电困难,促进地方经济的发展 |
| B、推广“低碳经济”,减少温室气体的排放 |
| C、推广“绿色自由”计划,吸收空气中的CO2并利用廉价能源合成汽油 |
| D、利用晶体硅制作的太阳能电池可将太阳能直接转化为电能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com