
【题目】按要求回答下列问题:
(1)硫酸工业生产中,反应产生SO2气体的设备名称___。
(2)以下物质中:①H2SO4,②CaCl2,③NaHS,④He,⑤镁。
化学键只含共价键的是___;只含离子键的是___。
(3)用双桥表示3Cl2+6KOH=5KCl+KClO3+3H2O电子转移的方和数目:___。
(4)在一定条件下,利用置换反应X+Y=W+Z,可实现物质之间的转化
①若X为Mg,W为C,则Z为(填化学式)___。
②若X为SiO2,工业上利用焦炭还原二氧化硅的化学方程式___。
【答案】沸腾炉 ① ② 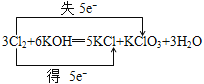 MgO SiO2+2C
MgO SiO2+2C![]() Si+2CO↑
Si+2CO↑
【解析】
(1)根据黄铁矿的主要成分为FeS2,煅烧时与O2反应生成Fe2O3和SO2,结合硫酸工业使用的设备回答;
(2)活泼金属和活泼非金属之间易形成离子键,非金属之间易形成共价键,据此分析解答;
(3)根据化合价的变化结合氧化还原反应的规律分析解答;
(4)①Mg与二氧化碳发生置换反应生成C和MgO;②焦炭高温下可以还原二氧化硅生成一氧化碳和硅,据此分析解答。
(1)黄铁矿的主要成分为FeS2,煅烧时与O2反应生成Fe2O3和SO2,黄铁矿煅烧的设备是沸腾炉,故答案为:沸腾炉;
(2)①H2SO4为共价化合物,只存在共价键;
②CaCl2是离子化合物,只含离子键;
③NaHS是离子化合物,含有离子键和共价键;
④氦气为单原子分子,无任何化学键;
⑤镁是金属单质,含有金属键;
只含共价键的是①;只含离子键的物质是②,故答案为:①;②;
(3)3Cl2+6KOH═5KCl+KClO3+3H2O中失电子的Cl元素化合价升高,得电子的Cl元素化合价降低,化合价降低数目=化合价升高数目=转移的电子数目=5,电子转移情况为: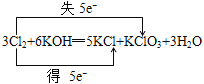 ,故答案为:
,故答案为: ;
;
(4)①若X为Mg,W为C,则Mg与二氧化碳发生置换反应生成C和MgO,所以Z为MgO,故答案为:MgO;
②若X为SiO2,焦炭高温还原二氧化硅生成一氧化碳和硅,化学方程式:SiO2+2C ![]() Si+2CO↑,故答案为:SiO2+2C
Si+2CO↑,故答案为:SiO2+2C ![]() Si+2CO↑。
Si+2CO↑。


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】Mg和SiO2在高温下反应生成MgO和Mg2Si。下列说法正确的是
A. 物质的熔点:Mg>MgOB. 氧元素不存在同素异形体
C. Mg的还原性强于SiD. 该反应是置换反应,镁元素被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在固定体积的密闭容器中发生反应:2HI(g)![]() H2(g)+I2(g)△H>0,0~15s内c(HI)由0.lmol/L降到0.07mol/L,则下列说法正确的是
H2(g)+I2(g)△H>0,0~15s内c(HI)由0.lmol/L降到0.07mol/L,则下列说法正确的是
A. 当HI、H2、I2浓度之比为2:1:1时,说明该反应达平衡
B. c(HI)由0.07mol/L降到0.05mol/L所需的反应时间小于10s
C. 升高温度正反应速率加快,逆反应速率减慢
D. 0~15s内用I2表示的平均反应速率为:v(I2)=0.001mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述错误的是
A. 在K37ClO3+6H35Cl(浓)=KCl+3Cl2↑+3H2O反应中,若电子转移的数目为5NA,则有212克氯气生成
B. 常温常压下,40g氖气所含的分子数目为2NA
C. 含2molH2SO4的浓硫酸与足量Zn完全反应,转移的电子数目可能为3NA
D. 标准状况下,33.6L Cl2与足量CH4在光照条件下充分反应,生成的C-Cl键数目为3.0NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有48.4g碱式碳酸镁样品(化学式:xMgCO3·yMg(OH)2·zH2O,x、y、z为正整数),将其分为二等份,一份样品充分灼烧至恒重进行热重分析,结果如图所示。另一份投入150mL某溶液的盐酸中,充分反应后生成CO24.48L(已知算成标准状况下),所得溶液稀释至250mL,测得溶液的c(H+)=0.100mol/L。

按要求回答下列问题:
(1)盐酸的物质的量浓度c(HCl)=______mol/L
(2)x:y:z=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4是一种清洁、高效、具有优良的环保性能的燃料,其燃烧热为890.3KJ·mol-1。它可以作为燃料电池的燃料。
(1)写出甲烷燃烧的热化学方程式:________;
(2)已知H2(g)和C(S)的燃烧热分别是285.8kJ·mol-1、393.5kJ·mol-1;则反应C(S)+ 2H2(g)=CH4(g)的反应热⊿H=______________;
(3)以甲烷、空气、氢氧化钾溶液为原料,惰性电极为电极可以构成燃料电池。该电池的负极反应式为:___________________;
(4)用(3)中的燃料电池为电源,以石墨为电极电解500mL滴有酚酞的NaCl溶液,装置如图所示:
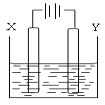
①请写出电解过程中阴极附近观察到的现象:___________________。
②到燃料电池消耗2.8LO2(标准状况下)时,计算此时NaCl溶液的pH=____(假设溶液的体积不变,气体全部从溶液中逸出)。
在Y极通过的电子的物质的量为:______________。
③电解之后,要使溶液恢复原状,应该向溶液中加入物质_____(填名称),溶液中Cl―流向___极(填“X”或“Y”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,W、Z核外电子数之和是X核外电子数的2倍,Y的最外层电子数是其质子数的![]() 。下列叙述正确的是
。下列叙述正确的是
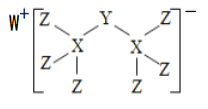
A. Y元素对应的最高价氧化物的水化物是强酸
B. 原子半径:X>Y>Z
C. 该新化合物中的Y元素不满足8电子稳定结构
D. Y、Z两元素可形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镇咳药沐舒坦可由化合物甲和化合物乙在一定条件下制得:

下列有关叙述正确的是( )
A. 甲的分子式为C7H4NBr2Cl
B. 沐舒坦分子中最多有13个碳原子共平面
C. 乙遇FeCl3溶液显紫色
D. 反应过程中加入适量K2CO3可提高沐舒坦的产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中是元素周期表的一部分,①~⑦分别表示元素周期表中对应位置的元素。
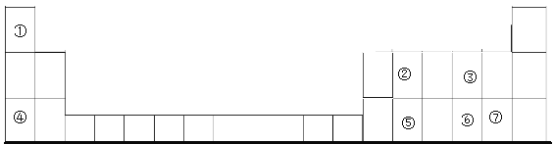
(1)元素⑤在周期表中的位置是___。
(2)元素①和⑥形成最简单化合物的电子式是___。元素②和③形成的一种化合物是造成温室效应的主要成分,该化合物的结构式为___。
(3)元素③和⑤形成的晶体属于___晶体。
(4)化合物A和化合物B均由元素①、③、④、⑥四种元素组成,它们的水溶液能互相反应,反应的离子方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com