
【题目】配制250mL0.10mol·L-1的NaOH溶液时,下列实验操作会使配得的溶液浓度偏大的是
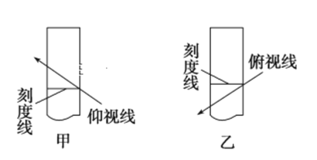
A.转移溶液后未洗涤烧杯和玻璃棒就直接定容
B.在容量瓶中定容时仰视刻度线
C.在容量瓶中定容时俯视刻度线
D.定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度线
科目:高中化学 来源: 题型:
【题目】聚维酮碘的水溶液是一种常用的碘伏类缓释消毒剂,聚维酮通过氢键与HI3形成聚维酮碘,其结构表示如图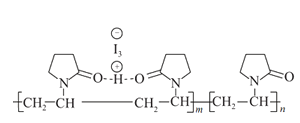 ,下列说法不正确的是( )
,下列说法不正确的是( )
A.聚维酮的单体是![]() B.聚维酮分子由(m+n)个单体聚合而成
B.聚维酮分子由(m+n)个单体聚合而成
C.聚维酮碘是一种水溶性物质D.聚维酮在一定条件下能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NaOH溶液清洗试管壁上的硫,发生反应S+NaOH—Na2SO3+Na2S+H2O(未配平)。下列说法不正确的是
A.方程式中含钠元素的化合物均含离子键和共价键
B.生成的Na2SO3 和Na2S的物质的量之比为1 : 2
C.方程式中S和H2O的化学计量数相同
D.清洗之后的废液呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO和H2生产燃料甲醇。一定条件下密闭容器中发生反应,测得数据曲线如下图所示(反应混合物均呈气态)。下列说法错误的是
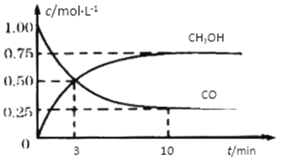
A.反应的化学方程式:CO+2H2![]() CH3OH
CH3OH
B.反应进行至3分钟时,正、逆反应速率相等
C.反应至10分钟,(CO) = 0.075 mol/L·min
D.增大压强,平衡正向移动,K不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于下列化学平衡在一定条件下发生移动的描述,不正确的是
A.Cl2+H2O![]() HCl+HClO,氯水中加入碳酸钙,漂白性增强
HCl+HClO,氯水中加入碳酸钙,漂白性增强
B.ZnS + Cu2+![]() CuS + Zn2+,闪锌矿(ZnS)遇CuSO4溶液转化为铜蓝(CuS)
CuS + Zn2+,闪锌矿(ZnS)遇CuSO4溶液转化为铜蓝(CuS)
C.2NO2![]() N2O4 ΔH<0,将装有NO2的玻璃球浸入热水中,红棕色变浅
N2O4 ΔH<0,将装有NO2的玻璃球浸入热水中,红棕色变浅
D.Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色) +2H+,K2Cr2O7溶液中滴加几滴浓硫酸,橙色加深
2CrO42-(黄色) +2H+,K2Cr2O7溶液中滴加几滴浓硫酸,橙色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸具有止血功效,存在于多种中药中,其结构简式为:
(1)写出咖啡酸中两种含氧官能团的名称:______________、____________。
(2)根据咖啡酸的结构,列举咖啡酸可以发生的三种反应类型:________、________、________。
(3)蜂胶的分子式为C17H16O4,在一定条件下可水解生成咖啡酸和一种醇A,则醇A的分子式为________。
(4)已知醇A含有苯环,且分子结构中无甲基,写出醇A在一定条件下与乙酸反应的化学方程式:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、为了研究化学反应A+B=C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:
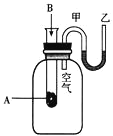
(1)该反应为________反应(填“放热”或“吸热”)。
(2)A和B的总能量比C和D的总能量_________(填“高”或“低”)。
(3)该反应的物质中的化学能通过化学反应转化成________释放出来。
(4)该反应的反应物化学键断裂吸收的能量________(填“高”或“低”)于生成物化学键形成放出的能量。
(5)Ⅱ、同素异形体相互转化的反应热相当小,而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成还是分几步完成,这个总过程的热效应是相同的”观点来计算反应热。
已知:
①P4(白磷,s)+5O2(g)= P4O10(s) ΔH=-2983.2 kJ·mol1
②P(红磷,s)+5/4O2(g)=1/4P4O10(s) ΔH=-738.5 kJ·mol1
则白磷转化为红磷的热化学方程式为__________。相同状况下,能量状态较低的是________;白磷的稳定性比红磷_________(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)+Q(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。
SO3(g)+NO(g)+Q(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。
完成下列填空。
(1)该反应中被氧化的元素是_____;写出该反应的平衡常数表达式:K=_____。
(2)若将NO2(g)和SO2(g)置于一密闭容器中进行上述反应。下列说法能表明反应达到平衡状态的是______(选填编号)。
a.混合气体颜色保持不变 b.NO2和NO的体积比保持不变
c.每消耗1mol SO2的同时生成1mol SO3 d.体系中气体密度保持不变
(3)一定温度下,在容积为V L的容器中发生上述反应,t min内,SO2的物质的量下降了a mol,则这段时间内v(NO)=_______(用相关字母表示并注明单位)。
(4)请写出两种能提高SO2转化率的措施:_________。
(5)亚硫酸溶液久置,pH会变小,请用化学方程式表示其原因___。
(6)将SO2持续通入NaOH溶液中,溶液中SO32-的浓度变化如图所示,请解释原因。__________。
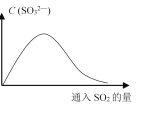
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. ![]() 和
和![]() 互为同素异形体 B. 红磷和白磷互为同位素
互为同素异形体 B. 红磷和白磷互为同位素
C. 邻二甲苯和对二乙苯互为同系物 D. CH3C(CH3)2CH3和![]() 互为同分异构体
互为同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com