
【题目】二氧化锰(MnO2)、高锰酸钾(KMnO4)均是常用的氧化剂。回答下列问题:
(1)MnO2能将SO2氧化生成MnSO4,反应的热化学方程式为MnO2(s)+SO2(g)=MnSO4(s) △H。
已知:
I.MnO2(s)=Mn(s)+O2(g) △H1=+520 kJ·mol-1
II.S(s)+O2(g)=SO2(g) △H2=-297 kJ·mol-1
III.Mn(s)+2O2(g)+S(s)=MnSO4(s) △H3=-1065 kJ·mol-1
则上述反应的△H=_________kJ·mol-1。
(2)某同学在实验室用标准Na2S2O3溶液测定KMnO4粗品的纯度,步骤如下:
①用_________(填仪器名称)称取0.7 g KMnO4粗品于锥形瓶中,加入一定量的蒸馏水将其溶解,然后加入_________(填“稀盐酸”或“稀硫酸”)进行酸化。
②250 mL 0.10 mol·L-1标准Na2S2O3溶液的配制,需要使用的玻璃仪器有烧杯、胶头滴管、量筒、玻璃棒和_________。
③将①所得溶液用0.10 mol·L-1的标准Na2S2O3溶液进行滴定。滴定至终点时记录消耗的Na2S2O3溶液体积如下表:

该KMnO4产品的纯度为_________(保留3位有效数字)。已知有关离子方程式为8MnO4-+5S2O32-+14H+=10SO42-+8Mn2++7H2O。
【答案】-248 托盘天平 稀硫酸 250 mL容量瓶 72.2%
【解析】
(1)根据盖斯定律,将已知的热化学方程式叠加,可得待求反应的热化学方程式;
(2)①固体质量用天平称量,利用KMnO4具有氧化性,结合使用酸的性质分析酸化的酸的种类;
②根据配制一定体积的物质的量浓度的溶液使用的仪器确定缺少的仪器的名称及规格;
③先根据实验数据,计算平均消耗Na2S2O3溶液体积,利用物质反应转化关系计算出KMnO4溶液的浓度,再计算其质量,最后根据纯度=![]() ×100%计算。
×100%计算。
(1) 已知:I.MnO2(s)=Mn(s)+O2(g) △H1=+520 kJ·mol-1
II.S(s)+O2(g)=SO2(g) △H2=-297 kJ·mol-1
III.Mn(s)+2O2(g)+S(s)=MnSO4(s) △H3=-1065 kJ·mol-1,根据盖斯定律,将III-II+I,整理可得:MnO2(s)+SO2(g)=MnSO4(s) △H=-248 kJ/mol;
(2)①KMnO4粗品要使用托盘天平进行称量;为增强KMnO4溶液的氧化性,要在配制的溶液中加入几滴酸溶液进行酸化,由于盐酸具有还原性,会与KMnO4溶液发生反应而消耗,所以要使用稀硫酸酸化;
②准确配制一定体积、一定物质的量浓度的溶液,仪器为天平、药匙、烧杯、量筒、玻璃棒、胶头滴管和一定规格的容量瓶,在实验室要配制250 mL 0.10 mol·L-1标准Na2S2O3溶液,根据容量瓶的规格及体积要求,需要使用250 mL的容量瓶。需要使用的玻璃仪器有烧杯、胶头滴管、量筒、玻璃棒,缺少250 mL容量瓶;
③三次实验消耗Na2S2O3溶液的平均体积V(Na2S2O3)=![]() =20.00 mL,根据反应方程式8MnO4-+5S2O32-+14H+=10SO42-+8Mn2++7H2O可知n(KMnO4)=
=20.00 mL,根据反应方程式8MnO4-+5S2O32-+14H+=10SO42-+8Mn2++7H2O可知n(KMnO4)=![]() n(Na2S2O3)=
n(Na2S2O3)=![]() ×0.1 mol/L×0.020 L=3.2×10-3 mol,则KMnO4的质量m(KMnO4)=3.2×10-3 mol×158 g/mol=0.5056 g,所以KMnO4的纯度为:
×0.1 mol/L×0.020 L=3.2×10-3 mol,则KMnO4的质量m(KMnO4)=3.2×10-3 mol×158 g/mol=0.5056 g,所以KMnO4的纯度为:![]() ×100%=72.2%。
×100%=72.2%。


科目:高中化学 来源: 题型:
【题目】关于下列装置的说法正确的是
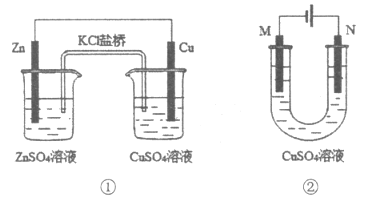
A.装置①中Cu为正极,电极上大量气泡产生
B.装置①中e-的迁移方向是:Zn→导线→Cu→盐桥→Zn
C.若装置②用于铁棒镀铜,则N极为铜棒
D.若装置②用于电解精炼铜,则电解前后溶液中的Cu2+浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某二元酸H2MO4在水中电离分以下两步:H2MO4H++HMO4-,HMO4-H++MO42-。常温下向20 mL0.1mol/L NaHMO4溶液中滴入cmol/LNaOH溶液,溶液温度与滴入NaOH溶液体积关系如图。下列说法正确的是
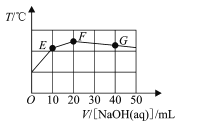
A.该氢氧化钠溶液pH=12
B.图像中F点对应的溶液中c(OH-)>c(HMO4-)
C.滴入NaOH溶液过程中水的电离程度一直增大
D.图像中G点对应的溶液中c(Na+)=c(HMO4-)+2c(MO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)是一种重要的化工原料,以FeO·Cr2O3为原料制备K2Cr2O7的流程如下:

已知:2FeO·Cr2O3+4Na2CO3+7NaNO3![]() 4Na2CrO4+Fe2O3+4CO2↑+7NaNO2
4Na2CrO4+Fe2O3+4CO2↑+7NaNO2
回答下列问题:
(1)写出滤渣的一种用途:___________________。
(2)“调节pH”可实现CrO42-和Cr2O72-在溶液中相互转化。室温下,若初始浓度为1.0 mol·L-1的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示:

①由图可知,溶液酸性增大,CrO42-的平衡转化率________(填“增大”“减小”或“不变”)。
②根据A点数据,计算出该转化反应的平衡常数为_________。
(3)流程中的“转化”过程中发生的反应属于_________(填基本反应类型)。
(4)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好完全沉淀(浓度等于1.0×10-5 mol·L-1)时,溶液中c(Ag+)为_______mol·L-1,此时溶液中c(CrO42-)等于________mol·L-1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断开1 mol Cl2(g)中Cl-Cl键需要吸收243 kJ能量。根据能量变化示意图,下列说法或热化学方程式正确的是

A.H2(g)+Cl2(g)=2HCl(g) △H=-185 kJ·mol-1
B.生成1 mol H2(g)中的H-H键放出121.5 kJ能量
C.断开1 mol HCl(g)中的H-Cl键要吸收864 kJ能量
D.HCl(g)=![]() H2(g)+
H2(g)+![]() Cl2(g) △H=-92.5 kJ·mol-1
Cl2(g) △H=-92.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将石油分馏得到的重油进行裂化可以获得较多的轻质燃油。某研究性学习小组模拟工业.上石油的催化裂化设计了如图所示实验装置。实验过程中可观察到烧瓶中固体石蜡先熔化,试管II中有少量液体生成,试管巩中酸性高锰酸钾溶液褪色,实验后闻试管II中液体的气味,发现其具有汽油的气味。

资料一 石蜡是含有20 ~ 30个碳原子的烷烃组成的混合物,常温下呈固态。
资料二 石油催化裂化过程中通常使用![]() 作催化剂。
作催化剂。
(1)为保证实验成功,实验前必须进行的操作是_________________;装置中长导管的作用是________________________。
(2)试管II中有少量液体生成说明________________。
(3)试管III中溶液褪色说明_______________________。
(4)_______(填“能”或“不能”)用试管II中的液体萃取溴水中的溴,理由是___________。
(5)写出二十烷裂化得到癸烷和癸烯的化学方程式:___________________________。
(6)石油裂化的主要目的是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是自然界碳循环中的重要物质。下列过程会引起大气中CO2含量上升的是
A. 光合作用 B. 自然降雨
C. 化石燃料的燃烧 D. 碳酸盐的沉积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl为白色粉末,微溶于水,不溶于乙醇,潮湿的CuCl在空气中被氧化为Cu2(OH)3Cl。
(1)一种由海绵铜(Cu)为原料制备CuCl的工艺流程如下:

①“溶解”步骤发生反应的离子方程式为_________________________________;
②潮湿的CuCl在空气中被氧化的化学反应方程式为_________________________________;
③已知常温下Cu(OH)2溶度积常数Ksp=2×10-20要使c(Cu2+)=0.2 mol·L-1的硫酸铜溶液中的铜离子沉淀比较完全(使铜离子浓度变为原来的千分之一)则应调节溶液pH为___________以上。
(2)次磷酸(H3PO2)是一元中强酸,可用于作金属表面处理剂。
①向Ba(H2PO2)2溶液中加入硫酸可以制取H3PO2,写出反应的化学方程式:_____________;
②H3PO2可将溶液中的Ag+还原为银,从而用于化学镀银,反应同时生成P元素最高价氧化物对应的水化物。在该过程中,氧化剂与还原剂的物质的量之比为:___________;
③NaH2PO2的水溶液呈弱碱性,用离子方程式说明原因:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.在轮船表面涂刷富锌油漆,能有效防止船体在海水中被腐蚀
B.0.1mol·L-1氨水加水稀释后,溶液中![]() 的值减小
的值减小
C.用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
D.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com