
【题目】某硫酸工业废渣的主要成分为SiO2、MgO、Al2O3、Fe2O3等。回收废渣中金属元素的工艺流程如下:
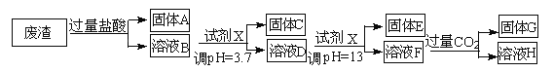
已知常温条件下:
①阳离子以氢氧化物形式开始沉淀和恰好完全沉淀(阳离子浓度等于10-5mol·L-1 )时的pH 如下表所
示。
阳离子 | Fe3+ | Al3+ | Mg2+ |
开始沉淀时的pH | 1.9 | 3.7 | 9.6 |
恰好完全沉淀时的pH | 3.2 | 5.2 | 11.0 |
②饱和氨水溶液中c(OH-)约为1×10-3mol·L-1。
请回答下列问题:
(1)固体C为_________(填化学式)。
(2)上述流程中两次使用试剂X,试剂X是_________(填“氨水”或“氢氧化钠”),其理由是_________________。
(3)溶液D→固体E的过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是________________。
(4)写出溶液F→溶液H 的离子方程式:__________________。
(5)Ksp[Mg (OH )2]=_____________。
【答案】 Fe(OH)3 氢氧化钠 经过计算饱和氨水的pH=11,使用氨水不能将溶液调至pH=13,所以选择氢氧化钠调节溶液酸醎性 镁离子沉淀不完全或氢氧化铝溶解不完全 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- l0-11
【解析】废渣中加入过量的盐酸,氧化镁溶解生成镁离子,氧化铝溶解生成铝离子,氧化铁溶解生成铁离子,二氧化硅不溶解,所以固体A为二氧化硅,溶液B中加入试剂X,调pH=3.7生成固体C为氢氧化铁,溶液D加入试剂X,调pH=13,则产生的沉淀为氢氧化镁,说明此时铝离子应以偏铝酸根离子存在,在试剂X为强碱,溶液F含有偏铝酸根,通入过量的二氧化碳,生成氢氧化铝沉淀,溶液H含有碳酸氢根离子。
(1).根据以上分析,固体C为氢氧化铁,故答案为: Fe(OH)3 ; (2)根据以上分析,且经过计算,饱和氨水溶液的pH为11,不能将溶液调成13,试剂X为氢氧化钠,。故答案为: 氢氧化钠;经过计算饱和氨水的pH=11,使用氨水不能将溶液调至pH=13,所以选择氢氧化钠调节溶液酸醎性;(3).根据铝离子和镁离子的完全沉淀时的pH数值分析,如果pH过小,镁离子沉淀不完全或氢氧化铝溶解不完全,故答案为:镁离子沉淀不完全或氢氧化铝溶解不完全; (4) 溶液F→溶液H为偏铝酸根离子与二氧化碳反应生成氢氧化铝和碳酸氢根离子的过程,离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-; (5) 镁离子完全沉淀时的pH为11,则氢氧根离子浓度为10-3mol/L,氢氧化镁的溶度积常数=10-5×(10-3)2=l0-11,故答案为:l0-11。


科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是
A. 油脂能在碱性条件下水解,可用于工业上制取肥皂
B. 碘单质易溶于有机溶剂,可用酒精萃取碘水中的碘
C. 二氧化锰具有较强的氧化性,可用于H2O2分解的氧化剂
D. 聚氯乙烯膜具有塑性和弹性,可用作食品保鲜膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式的反应热表示可燃物的燃烧热的是
A. H2(g)+I2(g)![]() 2HI(g) △H=-9.48 kJ mol-1
2HI(g) △H=-9.48 kJ mol-1
B. CH4(g)+2O2(g)=2H2O(g)+CO2(g) △H =-802.3 kJ mol-1
C. 2CO(g)+O2(g)= 2CO2(g) △H=-566 kJ mol-1
D. H2(g)+ ![]() O2(g)=H2O(l) △H=-285.8 kJ mol-1
O2(g)=H2O(l) △H=-285.8 kJ mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,相同体积的CO和C2H4的比较中正确的是( ) ①所含的分子数目之比为1:1 ②所含的质子数目之比为1:1
③所含的原子总数目之比为1:3 ④两者的密度之比为:1:1.
A.①②③④
B.①②④
C.②③④
D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇分子中不同的化学键如右图所示,关于乙醇在各种不同反应中断键的说法不正确的是( )

A. 和金属钠反应键①断裂
B. 在Ag催化下和O2反应键①④断裂
C. 和浓硫酸共热140℃时,键①或键②断裂,170℃时键②⑤断裂
D. 和氢溴酸反应键①断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使一镁铝合金粉末在过量稀H2SO4中溶解,在所得溶液中加入NaOH溶液,生成沉淀的质量w和加入NaOH溶液的体积V的关系如图所示,则该合金中镁和铝的质量之比为( ) 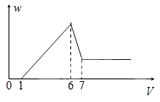
A.2:3
B.1:1
C.4:3
D.8:9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现应用酸碱中和滴定法测定某市售白醋的含酸量.
Ⅰ.实验步骤
(1)用___________(填仪器名称)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到100 mL________(填仪器名称)中定容,摇匀即得待测白醋溶液.
(2)取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴_________作指示剂.
(3)读取盛装0.1000 molL﹣1 NaOH 溶液的碱式滴定管的初始读数.如果液面位置如右图所示,则此时的读数为_______mL.
![]()
(4)滴定.滴定过程中,眼睛应注视__________________________; 当滴至____________________________________时停止滴定,并记录NaOH溶液的终读数.重复滴定4次.
Ⅱ.实验记录
实验序号 | 待测白醋溶液体积/mL | 0.1000mol·L-1 NaOH溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 20.00 | 0.10 | 15.10 |
2 | 20.00 | 0.00 | 14.95 |
3 | 20.00 | 0.15 | 15.20 |
4 | 20.00 | 1.10 | 17.10 |
Ⅲ.数据处理与讨论
(1)按实验所得数据,可折算得c(市售白醋)=________molL-1.
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是___填写序号)
a.碱式滴定管在装液前未用标准NaOH溶液润洗.
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失.
c.锥形瓶中加入待测白醋溶液后,再加少量水.
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关酶的说法错误的是( )
A.酶是具有催化作用的蛋白质
B.酶的催化作用具有选择性和专一性
C.高温或重金属盐能使酶失去生理活性
D.酶只有在强酸性或强碱性条件下才能发挥作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com