
【题目】使一镁铝合金粉末在过量稀H2SO4中溶解,在所得溶液中加入NaOH溶液,生成沉淀的质量w和加入NaOH溶液的体积V的关系如图所示,则该合金中镁和铝的质量之比为( ) 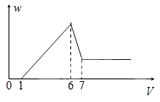
A.2:3
B.1:1
C.4:3
D.8:9
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】室温时,向20mL0.1mol·L-1醋酸溶液中不断滴入0.1mol·L-1的NaOH溶液,溶液pH变化如图所示。下列叙述错误的是
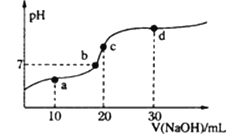
A. a点:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
B. b点:c(Na+)=c(CH3COOH)+c(CH3COO-)
C. c点:c(OH-)=c(CH3COOH)+c(H+)
D. d点:2c (Na+)=3[c(CH3COOH)+c(CH3COO-)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸工业废渣的主要成分为SiO2、MgO、Al2O3、Fe2O3等。回收废渣中金属元素的工艺流程如下:
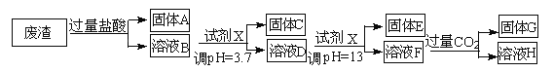
已知常温条件下:
①阳离子以氢氧化物形式开始沉淀和恰好完全沉淀(阳离子浓度等于10-5mol·L-1 )时的pH 如下表所
示。
阳离子 | Fe3+ | Al3+ | Mg2+ |
开始沉淀时的pH | 1.9 | 3.7 | 9.6 |
恰好完全沉淀时的pH | 3.2 | 5.2 | 11.0 |
②饱和氨水溶液中c(OH-)约为1×10-3mol·L-1。
请回答下列问题:
(1)固体C为_________(填化学式)。
(2)上述流程中两次使用试剂X,试剂X是_________(填“氨水”或“氢氧化钠”),其理由是_________________。
(3)溶液D→固体E的过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是________________。
(4)写出溶液F→溶液H 的离子方程式:__________________。
(5)Ksp[Mg (OH )2]=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F六种短周期主族元素,原子序数依次增大.已知A的气态氢化物能与其最高价氧化物的水化物反应,B原子最外层电子数是电子层数的3倍,C+和D3+离子的电子层结构相同,B与E属于同一主族.
请回答下列问题:
(1)E在元素周期表中的位置是
(2)上述元素形成的简单离子中,半径最小的是(填离子符号).
(3)由上述元素中的一种或几种组成的物质甲可以发生如图1反应:
①若乙具有漂白性,则乙的电子式为 .
②若丙的水溶液是强碱性溶液,则甲为或(填化学式).
③若乙为二元弱酸,丙既能溶于强酸、又能溶于强碱,则乙的名称为;用电离方程式表示丙既能溶于强酸、又能溶于强碱的原因 .
④乙遇空气变为红棕色,有同学认为“浓硫酸可以干燥气体甲”,为验证其观点是否正确.用如图2装置进行实验时,分液漏斗中应加入(填试剂名称).实验过程中,浓硫酸中未发现有气体逸出,且溶液变为红棕色,由此得出的结论是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国工业制硫酸主要反应有(均为放热反应):①4FeS2+11O2![]() 8SO2+2Fe2O3,②2SO2+O2
8SO2+2Fe2O3,②2SO2+O2 ![]() 2SO3,③SO3+H2O=H2SO4。回答下列问题:
2SO3,③SO3+H2O=H2SO4。回答下列问题:
(1)为了提高反应①硫铁矿的利用率,可采取的措施有____________________。工业上也可以使用硫作为制取硫酸的方法,1g硫粉在氧气中充分燃烧放出9.36 kJ热量,写出硫燃烧的热化学方程式__________________________。
(2)反应②中SO2的平衡转化率(α)与某条件的关系如下图所示,其中正确的是________。
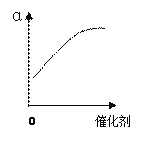

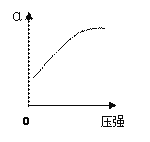
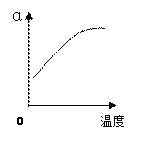
A B C D
(3)500oC和1.01×105Pa时将4.0 mol SO2和2.0 mol O2置于2L密闭容器中,反应达平衡时c(O2)=0.1 mol/L,则该反应的平衡常数等于_______,若将温度降到400oC,该反应的化学平衡常数__________(增大、减小或不变)。
(4)反应③得到“发烟硫酸”,往往稀释成98%的浓硫酸再出售。若分别用98%的浓硫酸、10%的稀硝酸、10%的稀醋酸分别与等量的NaOH溶液进行中和热的测定实验,三个反应的反应热依次为△H1、△H2、△H3,则它们的大小关系是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有CuO和Fe2O3组成的混合物ag,向其中加入2mol·L-1的硫酸溶液50mL,恰好完全反应。若将a g该混合物在足量H2中加热,使其充分反应,冷却后剩余固体质量为
A. 1.6a g B.(a-1.6)g C.(a-3.2) g D. 1.6 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com