
【题目】用NA表示阿伏加德罗常数的值。下列说法正确的是
A.0. 1 mol L-1的CaCl2 溶液中Ca2+的数目为0. lNA
B.标准状况 下,11. 2 L CHCl3 所含的分子数目为0. 5 NA
C.2. 8 g 乙烯含有的共用电子对的数目为 0. 6 NA
D.常温下,1 molFe与足量浓H2SO4反应,转移电子数为0.3NA
科目:高中化学 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:
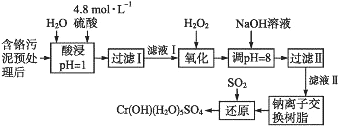
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4 mol·L-1的浓硫酸配制240 mL 4.8 mol·L-1的硫酸,需量取浓硫酸__mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需____________。
(2)酸浸时,为了提高浸取率可采取的措施有____________________。(答出两点)
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式_________________。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的ph | 2.7 | — | — | — |
沉淀完全时的ph | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-。滤液Ⅱ中阳离子主要有_______;但溶液的pH不能超过8,其理由是________________________。
(5)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是_____。
(6)写出上述流程中用SO2进行还原时发生反应的化学方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1mol·L-1的H2A溶液中各种微粒浓度的对数值(lgc)与pH的关系如图所示。
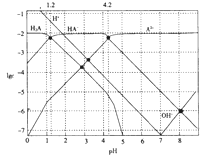
下列说法不正确的是
A. H2A是二元弱酸
B. HA-![]() H++A2-的电离平衡常数Ka=10-12
H++A2-的电离平衡常数Ka=10-12
C. 0.1mol·L-1的H2A溶液中:c(H+)=c(HA-)+2c(A2-)+c(OH-)
D. pH=4.2 时:c(HA-)=c(A2-)>c(H+)>c(H2A)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以玉米(主要成分是淀粉)为原料制备乙醇的流程如下:

下列说法中不正确的是
A. C12H22O11属于二糖B. 可采取分液的方法分离乙醇和水
C. 可用碘水检验淀粉是否完全水解D. 葡萄糖可以在酒曲酶作用下分解生成乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TMB是一种新型指纹检测的色原试剂,由碳、氢、氮三种元素组成,M=240g/mol。某研究性学习小组的同学欲利用下列仪器测定TMB的分子式。主要过程为在足量氧气流中将4.80 g TMB样品氧化(氮元素转化为N2),再利用吸收剂分别吸收水蒸气和CO2。请从图中选择适当的装置(装置符合气密性要求,加热装置等已略去,其他用品可自选)。
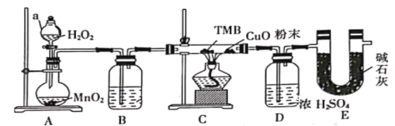
(1)写出仪器a的名称__________,A中的化学反应方程式:___________;
(2)B中试剂是___________,作用是________________ ;
(3)装置C中CuO粉末的作用为________________。
(4)理想状态下,将4.80 gTMB样品完全氧化,点燃C处酒精灯,实验结束时测得D增加3.60 g,E增加14.08 g,则TMB的分子式为____________。
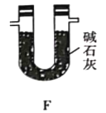
(5)有同学认为,用该实验装置测得的TMB分子式不准确,应在干燥管E后再添加一个装有碱石灰的干燥管F。你认为是否需要添加F装置__________(填“需要”或“不需要”),简述理由________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO在催化剂表面催化分解反应历程如图所示(TS表示反应中的过渡态)。下列有关说法中正确的是
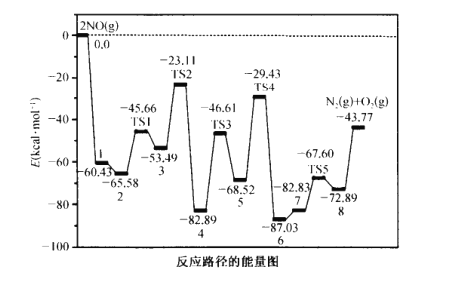
A.分解反应的热化学方程式为 2NO(g)![]() N2(g)+O2(g)△H = +43.77 kcal mol-1
N2(g)+O2(g)△H = +43.77 kcal mol-1
B.中间产物3中的键能大于中间产物4的,中间产物3更稳定
C.历程中“5→TS4→6”的活化能最大,该历程决定整个反应的快慢
D.使用高效催化剂,降低NO的相对能量,从而影响反应热的大小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属氮化物具有高熔点、高硬度、高化学稳定性以及良好的导热、导电性,目前已经广泛应用于磁学、电子工业 、耐高温结构陶瓷等领域 。回答下列问题
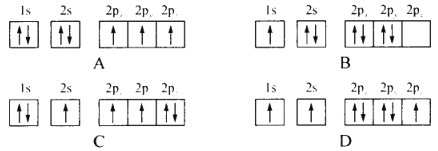
(1)下列不同状态的氮原子其能量最高的是________(填字母),基态氮原子处于最高能级的电子其电子云轮廓图形状为________
(2)第一电离能I1(N)______(填“> ”“< ”或“=”)I1(P),其原因是_____________。
(3)A和B两种金属的含氮化合物的结构如图所示:
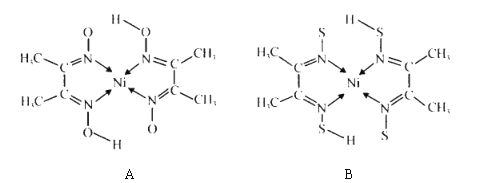
①基态 Ni 原子的核外电子排布式为[ Ar]________________。
②物质A 中碳原子的杂化方式为__________________。
③A的熔点高于 B 的,具主要原因是_______。
④B中含有的化学键类型有_____________(填字母)。
a.金属键 b. σ建
c.π键 d. 配位键
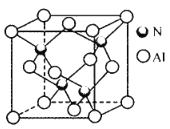
(4)氮化铝晶胞如图所示。氮原子的配位数为_______,每个铝原子周围紧邻__________个铝原子;已知立方氮化铝晶体密度为ρg cm-3,晶胞中最近的两个铝原子之间的距离为___pm(列出计算式即可,阿伏加德罗常数为6. 02×1023mol -1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物C的分子式为C9H9OCl。C分子中有一个甲基且苯环上只有一条侧链;一定条件下C能发生银镜反应;C与其他物质之间的转化如图所示:
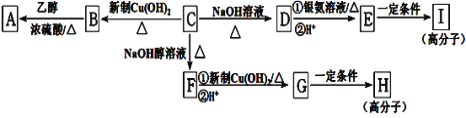
(1)C的结构简式是_____。
(2)E中含氧官能团的名称是______;C→F的反应类型是_____。
(3)写出下列化学方程式:G在一定条件下合成H的反应______。
(4)D的一种同系物W(分子式为C8H8O2)有多种同分异构体,则符合以下条件W的同分异构体有_____种,写出其中核磁共振氢谱有4个吸收峰的结构简式_____。
①属于芳香族化合物
②遇FeCl3溶液不变紫色
③能与NaOH溶液发生反应但不属于水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分离和提纯的方法错误的是
A.除去MgCl2溶液中的少量FeCl3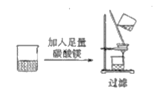
B.分离碘粉和铁粉的混合物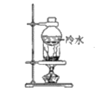
C.除去NaCl中的少量KNO3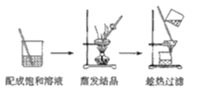
D.分离砂子、鸡蛋清和葡萄糖溶液的混合物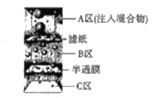
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com