
【题目】在25℃时,将气体X、Y放入密闭容器中发生反应生成Z,5min后达到平衡。其初始浓度和平衡浓度如下表:下列说法错误的是
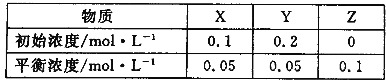
A.该反应可表示为 X+3Y![]() 2Z
2Z
B.反应达到平衡时,X的转化率为50%
C.前5min 以Y表示的平均反应速率为υ(Y)= 0.01 mol·L-1·min-1
D.增大压强使平衡向生成Z的方向移动
 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.苯是一种重要的化工原料,其产品在我们的生活中无处不在。
(1)一定条件下,利用如图所示装置可实现有机物苯(C6H6)到环己烷(C6H12)的转化。
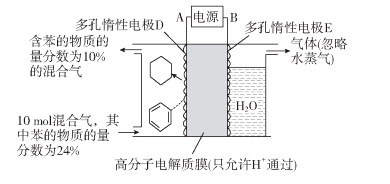
生成目标产物的电极反应式为__________;装置图右侧导出的气体是__________。
(2)已知苯和乙烯可以在催化剂存在的条件下发生加成反应。以苯和乙烯为原料可合成聚苯 乙烯,请设计合成路线(无机试剂及溶剂任选)。合成路线流程图示例如下:
H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
_________________________________________________________________________
II.丙烯是三大合成材料的基本原料,用于制丙烯腈、环氧丙烷、丙酮、甘油等。下图是以丙烯为原料合成甘油最重要的生产方法。
CH2=CHCH3 ![]() C3H5Cl
C3H5Cl ![]() C3H6OCl2
C3H6OCl2 ![]()
![]()
![]() 甘油
甘油
(3)①的反应类型是:____________
(4)产物C3H6OCl2有两种,选择一种写出反应③的化学方程式:____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4.74gK2SO4·Al2(SO4)3·nH2O的样品溶于水,配制成250ml溶液,取出20ml溶液,与浓度为0.064mol/L的氯化钡溶液25ml恰好完全反应生成沉淀.则K+的物质的量浓度为多少? n值为多少?
__________________、____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】进行化学实验必须注意安全,下列说法中正确的组合是
①点燃氢气前要检验氢气的纯度,以免发生爆炸
②CO气体有毒,处理CO气体时可将其点燃,转化为无毒的CO2
③在盛O2的集气瓶中进行铁丝燃烧实验时,事先在集气瓶底部铺上一层沙子
④用氢气还原氧化铜时,先加热再通入氢气,以免浪费氢气
⑤稀释浓硫酸的操作如下图所示

A.①②③④ B.①②③ C.①②④ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·浙江省温州中学高三3月模拟)以下是对某水溶液进行离子检验的方法和结论,其中正确的是
A.先加入BaCl2溶液,再加入足量的HNO3溶液,产生了白色沉淀。溶液中一定含有大量的![]()
B.加入足量的CaCl2溶液,产生了白色沉淀。溶液中一定含有大量的![]()
C.加入足量浓 NaOH溶液,产生了带有强烈刺激性气味的气体,该气体可以使湿润的红色石蕊试纸变蓝,则溶液中一定含有大量的![]()
D.先加适量的盐酸将溶液酸化,再加AgNO3溶液,产生了白色沉淀。溶液中一定含有大量的Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对气体或溶液中的离子鉴定方案正确的是
A.向溶液中加入硫酸酸化的NaCl溶液,生成白色沉淀,证明原溶液中含Ag+
B.向溶液中加入稀盐酸,生成能使澄清石灰水变浑浊的无色无味气体,证明原溶液中含![]()
C.向溶液中加入硝酸酸化的BaCl2溶液,生成白色沉淀,证明原溶液中含![]()
D.向溶液中加入浓NaOH溶液,加热后产生使湿润的红色石蕊试纸变蓝的气体,证明原溶液中含![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的值。下列说法正确的是( )
A. 向含有FeI2的溶液中通入适量氯气,当有1molFe2+被氧化时,该反应转移电子数目为3NA
B. 40gCuO和Cu2S混合物中所含铜原子的数目不等于0.5 NA
C. 含0.1molNH4HSO4的溶液中,阳离子数目略小于0.2NA
D. C3H8分子中的2个H原子分别被1个-NH2和1个-OH取代,1mol此有机物所含共用电子对数目为13NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R、M为元素周期表中前四周期的元素,其原子序数依次增大。X与W、Z与R是分别同族元素;X原子的第一电离能小于同周期前一族元素的原子;Z元素基态原子的核外有3个未成对电子;M元素的单质化学性质稳定,耐腐蚀,其单质及合金是一种优良的航天、航空材料,M的基态原子核外有2个未成对电子。请回答下列问题:
⑴NaZ3可应用于汽车安全气囊,当汽车发生碰撞时,气囊中的NaZ3迅速分解产生大量Z 的单质气体,从而使安全气囊瞬间充气弹出,减轻了乘员受到的伤害。基态Z原子价电子的电子排布图为_____________。与Z3-互为等电子体的分子的化学式为______________(写一个即可),Z3-的空间构型是__________。
⑵W元素可形成[WF6]3-、[WCl4]-配离子,而X只能形成[XF4]-配离子,由此可知决定配合物中配位数多少的因素之一是________________;
⑶已知Y的最高价含氧酸根离子与Na+、K+、NH4+形成的酸式盐溶解度都小于其正盐的溶解度,原因是HCO3-之间以________(填作用力)作用形成长链,减小了HCO3-与水分子之间的作用导致溶解度降低;
⑷R元素通常有白、红、黑三种颜色的单质,其中最稳定的同素异形体G在通常状态下是一种黑色有金属光泽的晶体,G在储能、电子和光伏发电等领域有着广泛的应用前景,是一种比石墨烯更优秀的新型材料。晶体G具有与石墨类似的层状结构,如图一所示。下列有关G的说法正确的是_______________;
A.G中R原子杂化方式为sp3杂化
B.G中层与层之间的作用力是配位健
C.与石墨类似,G的每一层中R原子都在同一平面上
D.R元素三种常见的单质中,G的熔沸点最高
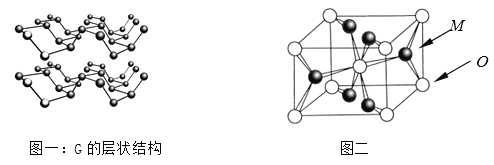
⑸M与O形成的离子晶体在自然界中存在三种形态,其中金红石型是三种形态中最稳定的一种,其晶胞如图二所示,则M、O配位数之比为________;影响离子晶体结构类型的因素有_____________、____________、键性因素。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com