
合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为CO(g)+H2O(g) CO2(g)+H2(g) △H<O。反应达到平衡后,为提高CO的转化率,下列措施中正确的是
CO2(g)+H2(g) △H<O。反应达到平衡后,为提高CO的转化率,下列措施中正确的是
A.增加压强 B.降低温度 C.增大CO的浓度 D.更换催化剂
B
【解析】
试题分析:提高CO的转化率,平衡向正反应方向进行,A、增加压强,因为反应前后气体系数之和相等,增大压强,化学反应速率增加,但化学平衡不移动,不符合题意;B、根据勒夏特列原理,降低温度平衡向放热反应方向进行,CO(g)+H2O(g) CO2(g)+H2(g) △H<0,正反应方向是放热反应,降低温度,化学平衡正向移动,CO的转化率提高,符合题意;C、根据勒夏特列原理,增大CO浓度,化学平衡正反应方向移动,但是CO总物质的量增加,转化率降低,不符合题意;D、催化剂只能加快反应速率,不影响化学平衡,不符合题意。选项B正确。
CO2(g)+H2(g) △H<0,正反应方向是放热反应,降低温度,化学平衡正向移动,CO的转化率提高,符合题意;C、根据勒夏特列原理,增大CO浓度,化学平衡正反应方向移动,但是CO总物质的量增加,转化率降低,不符合题意;D、催化剂只能加快反应速率,不影响化学平衡,不符合题意。选项B正确。
考点:考查勒夏特列原理的应用。
考点分析: 考点1:化学平衡状态及移动 试题属性

科目:高中化学 来源:2014-2015重庆市高一上学期第三次月考化学试卷(解析版) 题型:选择题
下列有关硅元素的叙述中,正确的是
A.水玻璃可用作木材防火剂 B.SiO2是良好的半导体材料
C.硅是地壳中含量最多的元素 D.SiO2不溶于水,也不溶于任何酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市丰台区高三第一学期期末练习化学试卷(解析版) 题型:选择题
X、Y、Z、W有如图所示的转化关系,则X、Y可能是

①C、CO ②S、SO2 ③N2 、NO ④AlCl3 、Al(OH)3
A.①② B.②③ C.③④ D.①④
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省泰安市高二上学期期末统考高二化学试卷(解析版) 题型:填空题
在一体积为10L的密闭客器中,通入一定量的CO和H2O,在85℃发生如下反应:
CO (g)+H2O(g)  CO2(g)+H2(g) △H<O。
CO2(g)+H2(g) △H<O。
CO和H2O浓度变化如图所示:

请回答下列问题:
(1)能判断该反应达到化学平衡状态的依据是___________________(填选项序号)。
a.容器中压强不变
b.混合气体中c(CO)不变
c. 正(H2)=
正(H2)=  逆(H2O)
逆(H2O)
d.c(CO2)=c(CO)
e.容器中气体密度不变
f.1 mol H-H键断裂的同时断裂2 mol H-O键
(2)①0~4min内的平均反应速率 (CO)=___________mol·L—1·min—1;
(CO)=___________mol·L—1·min—1;
②85℃时,该反应化学平衡常数K=____________。
(3)85℃时,若起始时向该容器中充入1.0 molCO、3.0 molH2O,则此时CO的平衡转化率为______________。
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省泰安市高二上学期期末统考高二化学试卷(解析版) 题型:选择题
在25℃时,若溶液中由水电离产生的c(OH—)=l×l0-14mol·L—1,满足此条件的溶液中一定可以大量共存的离子组是
A.Al3+、Na+、NO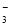 、Cl—
、Cl—
B.K+、Na+、Cl—、NO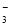
C.K+、Na+、Cl—、[Al(OH)4]—
D.K+、NH 、SO
、SO 、NO
、NO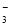
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省泰安市高二上学期期末统考高二化学试卷(解析版) 题型:选择题
室温下,等物质的量浓度的下列溶液中,水的电离程度大小的正确排列顺序是
①NH4Cl ②NaCl ③KNO3 ④NaOH
A.①>④>②=③ B.④>②=①>③ C.①>②=③>④ D.②>③>①>④
查看答案和解析>>
科目:高中化学 来源:2014-2015山西省忻州市高二上学期期末考试化学试卷(解析版) 题型:实验题
(18分)H2O2作为氧化剂在反应时不产生污染物被称为绿色氧化剂,因而受到人们越来越多的关注。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答下列问题:

(1)定性分析:图甲可通过观察____________,定性比较得出结论。有同学提出将FeCl3溶液改为Fe2(SO4)3溶液更合理,其理由是_____________ 。
(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为_________,检查该装置气密性的方法是:关闭分液漏斗的活塞,将注射器活塞向外拉出一段后松手,过一段时间后看 ,实验中需要测量的数据是_____________________________________。
(3)加入0.1 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。

写出H2O2在MnO2作用下发生反应的化学方程式_________________________。
②A、B、C、D各点反应速率由大到小的顺序为__________。
③反应速率由D到A逐渐变化的原因是:随着反应的进行,反应物浓度逐渐________,(填 “增大”或“减小”)反应速率逐渐_________。(填 “加快”或“减慢”)
④计算H2O2的初始物质的量浓度为________ mol/L。(保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源:2014-2015山西省忻州市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列变化过程,属于放热过程的是
①液态水变成水蒸气; ②酸碱中和反应; ③浓H2SO4稀释;
④固体氢氧化钠溶于水; ⑤H2在Cl2中燃烧; ⑥弱酸电离;
⑦NH4Cl晶体与Ba(OH )28H2O混合搅拌.
A.①③⑤ B.①⑥⑦ C.②④⑦ D.②③④⑤
查看答案和解析>>
科目:高中化学 来源:2014-2015山西省校高一上学期期末考试化学试卷(解析版) 题型:选择题
下列反应既表现硝酸的酸性,又显示硝酸的氧化性的是
A. CuO+2HNO3=Cu(NO3)2+H2O B. FeO+4HNO3=Fe(NO3)3+2H2O+NO2↑
C. C+4HNO3=CO2↑+2H2O+4NO2↑ D. NH3+HNO3=NH4NO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com