
����Ŀ���±���ij��ȤС��ͨ��ʵ���õ���ͬ�������ϡ����������Ӧ��ʵ�����ݣ�
ʵ�� ��� | ���� ����/g | ���� ״̬ | c��H2SO4�� mol/L | ʵ�� �¶�/�� | ������ʧ ��ʱ��/s |
1 | 0.10 | ˿ | 0.7 | 20 | 250 |
2 | 0.10 | ˿ | 1.0 | 20 | 200 |
3 | 0.10 | ��ĩ | 1.0 | 20 | 125 |
4 | 0.10 | ��ĩ | 1.0 | 30 | 50 |
�����������ݣ��ش��������⣺
��1����ʵ��1��2�ɵó��Ľ����ǣ�����Ũ��Խ_____����Ӧ����Խ����
��ʵ��3��4�ɵó��Ľ������¶�Խ_____����Ӧ����Խ�죮
��2���������ۺ�ϡ���ᷴӦ��ȡH2��ʵ������л��Ƴ�����H2�������V����ʱ�䣨t���Ĺ�ϵ��ͼ��ʾ�� �Է����ж�OE�Ρ�EF�Ρ�FG�Ρ�GH�η�Ӧ���ʣ��ֱ���v ��OE����v ��EF����v ��FG����v ��GH����ʾ�����ʱ����______��
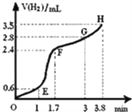
A��v ��OE�� B��v ��EF��C��v ��FG�� D��v ��GH��
��1min�ڷ�Ӧ������ԭ���ǣ�_________��һ��ʱ���Ӧ���Լӿ��ԭ����_____��
���𰸡� С �� B �¶Ƚϵ� ��Ӧ���ȣ��¶�����
�������������������1����ʵ��1��2Ψһ�ı����������Ũ�ȣ�����Ũ�ȴ�ķ�Ӧʱ��̣���ʵ��3��4Ψһ�ı������¶����¶ȸߵķ�Ӧʱ��̣���2���ٸ������ʶ���![]() �������ڸ���Ӱ�����ʵ����ط�����
�������ڸ���Ӱ�����ʵ����ط�����
��������1����ʵ��1��2Ψһ�ı����������Ũ�ȣ�����Ũ�ȴ�ķ�Ӧʱ��������Ը���ʵ��1��2�ɵó��Ľ����ǣ�����Ũ��ԽС����Ӧ����Խ������ʵ��3��4Ψһ�ı������¶����¶ȸߵķ�Ӧʱ��������Ը���ʵ��3��4�ɵó��Ľ������¶�Խ�ߣ���Ӧ����Խ������2���ٸ������ʶ���![]() ����λʱ������������Խ�࣬��Ӧ����Խ�죬����EF�η�Ӧ������죬��ѡB���ڸ÷�Ӧ���ȣ���Һ�¶����ߣ���ʵ�������ʹ��Ӧ���ʼӿ���������¶ȣ�����1min�ڷ�Ӧ������ԭ�����¶ȵͣ�һ��ʱ���Ӧ���Լӿ��ԭ���ǣ���Ӧ���ȣ��¶����ߡ�
����λʱ������������Խ�࣬��Ӧ����Խ�죬����EF�η�Ӧ������죬��ѡB���ڸ÷�Ӧ���ȣ���Һ�¶����ߣ���ʵ�������ʹ��Ӧ���ʼӿ���������¶ȣ�����1min�ڷ�Ӧ������ԭ�����¶ȵͣ�һ��ʱ���Ӧ���Լӿ��ԭ���ǣ���Ӧ���ȣ��¶����ߡ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ܱ������г�������ʵ�����A��B��һ���¶��·�����ӦA(g)��xB(g)![]() 2C(g)�ﵽƽ����ڲ�ͬ��ʱ��Σ��ֱ�ı�Ӱ�췴Ӧ��һ����������������и����ʵ������Ũ�ȡ���Ӧ���ʷֱ���ʱ��ı仯����ͼ��ʾ��
2C(g)�ﵽƽ����ڲ�ͬ��ʱ��Σ��ֱ�ı�Ӱ�췴Ӧ��һ����������������и����ʵ������Ũ�ȡ���Ӧ���ʷֱ���ʱ��ı仯����ͼ��ʾ��

����˵������ȷ����
A. 4 minʱ��Ӧ��һ�δﵽƽ��
B. 15 minʱ����ѹǿ��20 minʱ�����¶�
C. ��Ӧ����ʽ�е�x��1������ӦΪ���ȷ�Ӧ
D. 15��20 min�÷�Ӧʹ���˴���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������е����ɵ��Ӹ����ڷ��ӻ�ԭ�����γɵĿ��������ӣ�Ҳ�������ӣ�����Ϊ������ά���ء���O2������һ�ֿ��������ӣ���Ħ������Ϊ�� ��
A.32 g
B.33 g
C.32 gmol��1
D.33 gmol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԪ�ػ�̬ԭ�������ĵ����Ų�ʽ���£������ܱ�ʾ��Ԫ��һ��Ϊ����Ԫ�ص��ǣ� ��
A.3s23p6B.ns2C.4s24p1D.4s1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪2A2(g)+B2(g)![]() 2C(g)����H=-a kJ��mol-1(a>0),��һ���д����Ĺ̶��ݻ��������м���2 mol A2��1 mol B2,��500 ��ʱ��ַ�Ӧ�ﵽƽ���C��Ũ��Ϊw mol��L-1,�ų�����b kJ��
2C(g)����H=-a kJ��mol-1(a>0),��һ���д����Ĺ̶��ݻ��������м���2 mol A2��1 mol B2,��500 ��ʱ��ַ�Ӧ�ﵽƽ���C��Ũ��Ϊw mol��L-1,�ų�����b kJ��
��1��a___(����>����=������<��)b��
��2��������Ӧ�¶����ߵ�700 ��,�÷�Ӧ��ƽ�ⳣ����___(��������������С������������)��
��3������ԭ����������ֻ����2 mol C,500 ��ʱ��ַ�Ӧ�ﵽƽ���,��������c kJ,C��Ũ��___(����>����=������<��)w mol��L-1��
��4����˵���÷�Ӧ�Ѿ��ﵽƽ��״̬����___��
a.v(C)=2v(B2) b.������ѹǿ���ֲ���c.v��(A2)=2v��(B2)d.������������ܶȱ��ֲ���
��5��ʹ�÷�Ӧ�ķ�Ӧ��������,��ƽ��������Ӧ�����ƶ��IJ�����___��
a.��ʱ�����C����b.�ʵ������¶�c.����B2��Ũ�� d.ѡ���Ч�Ĵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����л������������ȷ����(����)
A. ��֬��ϡ���������������Һ�о��ɷ���ˮ�ⷴӦ������ˮ�������ͬ
B. ȡ������ϡ���Ṳ�Ⱥ����Һ����������������Һ���ȣ�û������������˵��������δˮ������������
C. �ṹʽΪ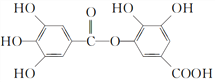 ���л��������ϡ������·���ˮ�ⷴӦ����ˮ�����ֻ��һ��
���л��������ϡ������·���ˮ�ⷴӦ����ˮ�����ֻ��һ��
D. ��ά�ء����ǡ������ǡ���������һ�������¾��ɷ���ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ϥ��ʹ����ѧ��ѧʵ���г�����������Ʒ���ǻ�ѧѧϰ�Ļ���Ҫ���Իش��������⣺
��1�� �������� a����Һ©�� b���Լ�ƿ c������ƿ d���ζ��� e������ƿ f����Ͳ g��������ƽ h�������� i����ͷ�ι��У�������0���̶ȵ��ǣ�����ţ�___________________��������һ�����ʵ���Ũ��H2SO4��Һ���õ���Ҫ�����У�����ţ�________________��
��2���������ʹ�ã�����Һ�����������У��ٰ�������ŵ�����̨����Ȧ�ϡ��þƾ��Ƽ��ȣ�ͬʱ�ò��������Ͻ��裬��Ŀ����__________________________��
��3�� ��װ�üס��ҡ������齺�����һ��װ�ã��������Ѽ�飩����������ȡ���ռ�NH3��HCl���塣�ɹ�ѡ���Һ���Լ��У�Ũ���ᡢŨ���ᡢŨ��ˮ�������Լ�Ϊ��ɫʯ����Һ����ش��������⣺

�� ����ȡij����Ĺ����У����е�ʯ����Һ��죬����ƿ�е��Լ�A���Һ©���е��Լ�B��Ϊ��ɫҺ�壬���Լ�AΪ_____________________________����ȡ������������B��������________________ ��__________________��ͨ��������ɫʯ����Һ���������˵�����������Ѽ�������ʯ����Һ����������ƿ����Ӧ����Ĺ����Լ�AΪ____________��
�� ���������ռ���������������װ�õ�˳���ǣ�a��___��___��d����ӿڴ��ţ���
��4����ͼ�е�װ��D��ʵ�����Ʊ�CO2�ļ���װ��ͼ���ø�װ���Ʊ�CO2������ʱʹ��Ӧ������Ҳ������ʱʹ��Ӧֹͣ��Ч���� ����ͼ�е�װ��A��B��CҲ������ͬЧ������_________________����д��ţ���
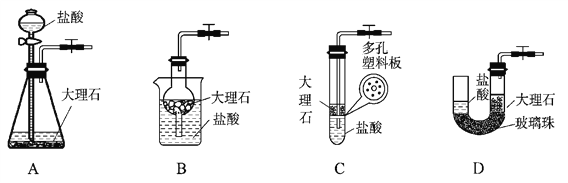
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ͭ�����γɶ��ֽ������������һ�־���Ľṹ��ͼ��ʾ��Ϊ����������ṹ���� 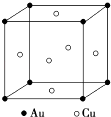
��1���ý���������Ļ�ѧʽΪ ��
��2����֪Au �����ԭ������Ϊ197��Cu�����ԭ������Ϊ64�������ӵ�����ΪNA �� ���û�������ܶ�Ϊdgcm��3 �� �Լ������Ͼ��������������ԭ�ӵĺ˼��Ϊcm��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȫȼ��һ����������ˮ�Ҵ����ų�������ΪQ����֪Ϊ����ȫ�������ɵĶ�����̼������50mL 8mol/L������������Һ������ˮ�Ҵ���ȼ�շų���������������(����)
A. 10Q B. 5Q��10Q C. ����10Q����5Q D. ��8Q
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com