
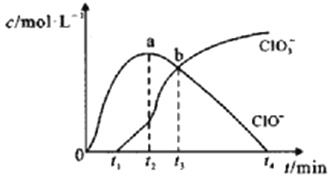
【题目】室温下,用滴定管量取一定体积的浓氯水置于锥形瓶中,用NaOH溶液以恒定速度来滴定该浓氯水,根据测定结果绘制出ClO-、ClO3-等离子的物质的量浓度c与时间t的关系曲线如下。下列说法正确的是( )
A.NaOH溶液和浓氯水可以使用同种滴定管盛装
B.a点溶液中存在如下关系:c(Na+) + c(H+) = c(ClO-)+ c(OH-)+ c(ClO3-)
C.b点溶液中各离子浓度:c(Na+) > c(Cl-) > c(ClO-) = c(ClO3-)
D.t2~t4,ClO-的物质的量下降的原因可能是ClO-自身歧化:2ClO-= Cl-+ ClO3-
【答案】C
【解析】
A. NaOH能腐蚀活塞,所以不能盛放在酸式滴定管中;氯水溶液呈酸性且具有强氧化性,能腐蚀橡胶,所以不能盛放在碱式滴定管中,故A错误;
B. 该溶液中还含有Cl-,电解质溶液呈电中性,溶液中阴阳离子所带电荷相等,根据电荷守恒得c(Na+) + c(H+) = c(ClO-)+ c(OH-)+ c(Cl-)+ c(ClO3-),故B错误;
C. 根据图知,该溶液中c(ClO-) = c(ClO3-),氯气发生化学反应离子方程式为Cl2 + OH- = Cl-+ ClO- + H2O、3Cl2 + 6OH- = 5Cl-+ ClO- + 3H2O,根据方程式知c(Cl-) > c(ClO3-),根据电荷守恒知:c(Na+) + c(H+) = c(ClO-)+ c(OH-)+ c(Cl-)+ c(ClO3-),故c(Na+) > c(Cl-),所以存在c(Na+) > c(Cl-) > c(ClO-) = c(ClO3-),故C正确;
D. 该离子方程式转移电子不守恒,根据转移电子守恒得3ClO-= 2Cl-+ ClO3-,故D错误。
综上所述,答案为C。


科目:高中化学 来源: 题型:
【题目】如图装置中,容器甲内充入0.1 mol NO气体。干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体。恒温下,容器甲中活塞缓慢由D处向左移动,当移至C处时容器体积缩至最小,为原体积9/10,干燥管中物质的质量增加了2.24 g。随着CO2的继续通入,活塞又逐渐向右移动。下列说法中正确的是
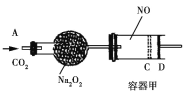
A. 活塞从D处移动到C处的过程中,通入的CO2气体为2.24 L(标准状况)
B. NO2转化为N2O4的转化率为20%
C. 容器甲中NO已反应完
D. 活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处,则a小于0.01
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备乙酸乙酯的实验装置如图所示:
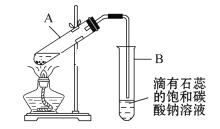
(1)A中浓硫酸的作用是________。
(2)实验时预计试管B中产生的现象有:___、___(答2点)。
(3)欲从试管B中分离出乙酸乙酯,采用的方法是_______(填操作名称);若要对产品乙酸乙酯进行干燥,__(填“能”或“不能”)用碱石灰干燥,理由是______。
(4)写出实验室用乙醇和乙酸制取乙酸乙酯的化学方程式:_______。
(5)若在A中加入4.6 g的乙醇、9.0 g的乙酸、数滴浓硫酸,缓慢加热A至充分反应,最后将产品进行纯化,得乙酸乙酯5.28 g,本实验的产率是________。备注:产率指的是某种生成物的实际产量与理论产量的比值。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.汽车尾气是城市空气的污染源之一。治理的方法之一是在汽车的排气管上装一个“催化转换器”。它可以使CO与NO反应,生成可参与大气循环的无毒气体。
(1)下列与汽车尾气的排放密切相关的是___________(填序号)。
A.光化学烟雾 B.水体富营养化与赤潮
C.白色污染 D.雾霾
(2)写出一氧化碳与一氧化氮反应的化学方程式:________________
Ⅱ.减少交通事故除遵守交通法规正确驾驶外,安全措施也极为重要。汽车的安全气囊内有叠氮化钠(NaN) I 与硝酸钱(NH4NO3)等物质。当汽车在高速行驶中受到猛烈撞击时,这些物质会迅速发生分解反应,产生大量气体,充满气囊,从而保护驾驶员和乘客的安全。
(3)下列判断正确的是____________填序号)。
A.道路起雾与H2O分子中的化学键断裂有关
B.NH4NO3中只含有极性共价键
C.NaN3受到猛烈撞击时有化学键的断裂
D.NaN3、NH4NO3均属于离子化合物
(4)汽车的安全气囊内叠氮化钠爆炸过程中的能量变化如图所示:

①叠氮化钠的爆炸反应属于__________(填“吸热”或“放热”)反应。
②若上述爆炸过程中的能量变化为2(a-b)kJ,则消耗叠氮化钠的质量为 __________g。
③若安全气囊的体积为V L,NaN3的爆炸在ts内完成,反应过程中消耗292.5 g NaN3,则用N2表示的反应速率为____________mol L-1 s-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置制备并检验Cl2的性质。下列说法正确的是
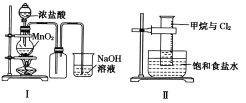
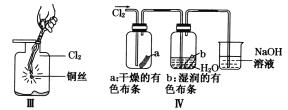
A. I图中:如果MnO2过量,浓盐酸就可全部被消耗
B. II图中:量筒中发生了加成反应
C. III图中:生成蓝色的烟
D. IV图中:湿润的有色布条能褪色将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各种变化属于原电池反应的是( )
A.在空气中金属铝表面迅速氧化形成保护层
B.工业上用饱和的食盐水制备氯气和烧碱
C.锌与稀硫酸反应时,加入少量的硫酸铜溶液,可加快反应速率
D.铜在空气中加热变黑,趁热立即插入无水乙醇中又变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:![]() (正反应为放热反应),673K、30MPa下,n(NH3)和n(H2)随时间t变化的关系如图所示。下列叙述中正确的是
(正反应为放热反应),673K、30MPa下,n(NH3)和n(H2)随时间t变化的关系如图所示。下列叙述中正确的是
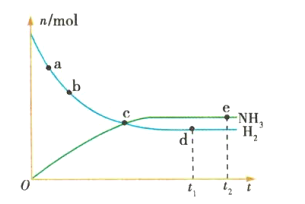
A.c点处正反应速率和逆反应速率相等
B.a点的正反应速率比b点的大
C.d点(t1时刻)和e点(t2时刻)处n(N2)不同
D.在t2时刻,正反应速率大于逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是五种短周期元素的原子序数与其在氢化物中化合价的关系图,则下列说法不正确的是( )
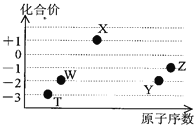
A.X的氢化物具有很强的还原性
B.YW2、ZW2、X2W2都能使品红溶液褪色,且褪色原理相同
C.Y、Z元素的最高价氧化物对应的水化物都呈酸性,而且酸性:HZO4 > H2YO4
D.元素W、T的氢化物的沸点比同主族中相邻的氢化物高,是因为这两种氢化物分子间存在氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某学校化学兴趣小组欲用下列装置制取纯净的氯气及氯化物,并探究其性质。

回答下列问题:
(1)链接好实验装置后的第一步实验操作是__________________;仪器x的名称是_____________;装置B中的试剂是_____________________。
(2)查阅数据知:浓盐酸可与K2Cr2O7固体发生反应生成氯气(Cr2O72-变为Cr3+),写出上述反应的化学方程式:_________________________________;该反应中还原剂是_________________。
Ⅱ.甲醇(CH3OH)是一种无色有刺激性气味的液体,在生活中有重要用途,同时也是一种重要的化工原料。
(3)甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气、KOH溶液(电解质溶液)构成,则下列说法正确的是_________________。
(已知甲醇在空气中燃烧生成CO2和H2O)
A.电池放电时通入空气的电极为负极
B.电池放电时负极的电极反应式为![]()
C.电池放电时,电解质溶液的碱性逐渐减弱
D.电池放电时每消耗6.4gCH3OH转移1.2 mol 电子
(4)写出甲醇燃料电池在酸性条件下负极的电极反应式:________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com