
【题目】氮的最高价氧化物为无色晶体,它由两种离子构成,已知其阴离子构型为平面三角形,则其阳离子的构型和阳离子中氮的杂化方式为( )
A. 平面三角形 sp2杂化B. V形 sp2杂化
C. 三角锥形 sp3杂化D. 直线形 sp杂化
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图中的Ⅰ是某抗肿瘤药物的中间体,B的核磁共振氢谱有3组峰,C的分子式为C7H8O,D分子中有两个相同且处于相邻位置的含氧官能团,E的相对分子质量比D大34.5。
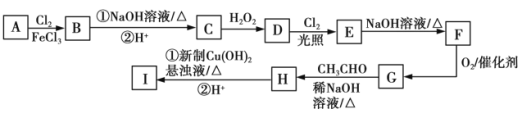
已知:RCHO+R1CH2CHO![]() RCH=C(R1)CHO+H2O。
RCH=C(R1)CHO+H2O。
请回答下列问题:
(1)C的名称是______,B的结构简式为_________,D转化为E的反应类型是____________。
(2)I中官能团的名称为______,I的分子式为________。
(3)写出E转化为F的化学方程式____________。
(4)X是G酸化后的产物,X有多种芳香族同分异构体,符合下列条件且能发生银镜反应的同分异构体有____种(不包括X),写出核磁共振氢谱有4组峰的物质的结构简式____________。
①遇FeCl3溶液发生显色反应 ②苯环上有两种类型的取代基
(5)参照上述流程,以乙醇为原料(其他无机试剂自选)可制取2﹣丁烯酸,写出相应的合成路线__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g) + 5O2(g) ![]() 4NO(g) + 6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率
4NO(g) + 6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率![]() x
x
A. ![]() (O2) = 0.01mol·(L·s) –1 B.
(O2) = 0.01mol·(L·s) –1 B. ![]() (NO) = 0.008mol·(L·s) –1
(NO) = 0.008mol·(L·s) –1
C. ![]() (H2O) = 0.006mol·(L·s) –1 D.
(H2O) = 0.006mol·(L·s) –1 D. ![]() (NH3) = 0.002mol·(L·s) –1
(NH3) = 0.002mol·(L·s) –1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环氧乙烷(![]() )是一种最简单的环醚,常用于有机合成。某研究小组以环氧乙烷和甲苯为原料按下列流程合成有机化合物G和I。
)是一种最简单的环醚,常用于有机合成。某研究小组以环氧乙烷和甲苯为原料按下列流程合成有机化合物G和I。
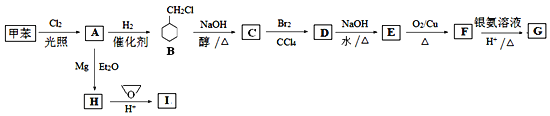
已知:CH3Cl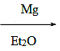 CH3MgCl
CH3MgCl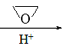 CH3CH2CH2OH
CH3CH2CH2OH
回答下列问题:
(1)A分子中最多有_____个原子共平面。
(2)D的结构简式为_____。
(3)写出下列反应的化学方程式:
E→F:______;G和I在浓硫酸催化下生成酯:______。
(4)I有多种同分异构体,写出其中满足以下条件的同分异构体的结构简式:_______。
①属于芳香族化合物; ② 能与FeCl3溶液发生显色反应;
③核磁共振氢谱显示不同环境的氢原子个数比1:2:3:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿![]() (主要成分为
(主要成分为![]() ,含FeO杂质)为原料冶炼铝的工艺流程如下:
,含FeO杂质)为原料冶炼铝的工艺流程如下:

下列说法正确的是( )
A.试剂X可以是氢氧化钠溶液,也可以是盐酸溶液
B.反应①过滤后所得沉淀为氢氧化铁
C.图中所示转化反应都不是氧化还原反应
D.反应②的化学方程式为CO2 + Na[Al(OH)4] = NaHCO3 + Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Fe(CO)5中铁的化合价为0,写出铁原子的简化的基态电子排布式______,Fe在周期表中第______周期______族,属于_______区。
(2)已知Fe(CO)5常温下呈液态,熔点为﹣20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体为________(填晶体类型)。
(3)金属铁单质的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。
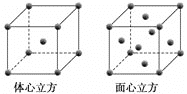
体心立方晶胞和面心立方晶胞中实际含有的铁原子个数之比为________;Fe原子配位数之比为____。若两种晶体中最邻近的铁原子间距离相同,则体心立方晶胞和面心立方晶胞密度之比为_______。
(4)已知:Y原子最高价氧化物对应水化物的酸性最强。铜与Y形成化合物的晶胞如图所示(黑点代表铜原子,空心圆代表Y原子)。
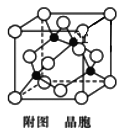
①该晶体的化学式为________。(用元素符号表示)
②已知该晶体的密度为ρ g/cm3,阿伏加德罗常数为NA,则该晶胞边长为______nm(只写计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为FeSmAsFO组成的化合物。回答下列问题:
(1)元素As与N同族。预测As的氢化物分子的立体结构为_______,其沸点比NH3的_______(填“高”或“低”),其判断理由是_________________________。
(2)Fe成为阳离子时首先失去______轨道电子,Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为______________________。
(3)比较离子半径:F__________O2(填“大于”等于”或“小于”)。
(4)一种四方结构的超导化合物的晶胞结构如图1所示,晶胞中Sm和As原子的投影位置如图2所示。
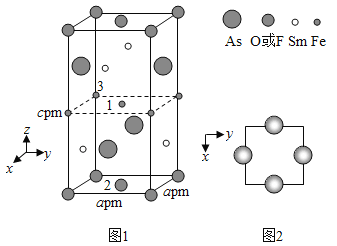
图中F和O2共同占据晶胞的上下底面位置,若两者的比例依次用x和1x代表,则该化合物的化学式表示为____________,通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=________g·cm3。
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(![]() ),则原子2和3的坐标分别为__________、__________。
),则原子2和3的坐标分别为__________、__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷在不同溶剂中与NaOH反应生成不同的产物,同学们据此展开探究。
(实验1)甲同学利用如图所示装置进行实验:
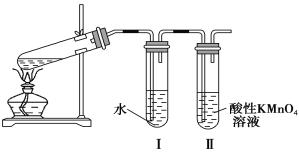
(1)甲同学的实验目的为____________________________。
(2)实验过程中可观察到试管Ⅱ中的现象为__________________________________________________。
(3)试管Ⅰ的作用为_________________________________________________________。
(实验2)乙同学在试管中加入3 mL溴乙烷和3 mL NaOH溶液,振荡,加热。
(4)此反应的化学方程式为_________________________________________。
(5)停止加热并冷却后,欲证明确实发生了上述反应,还应进行的操作为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸是重要的化学试剂和工业原料。请回答下列问题:
(1)已知:25℃时,磷酸和氢氟酸的电离常数如下表所示。
物质 | H3PO4 | HF |
电离常数 | Ka1=7.1×103; Ka2=6.3×108; Ka3=4.2×1013 | Ka=6.6×104 |
向NaF溶液中滴加少量H3PO4溶液,反应的离子方程式为____________
(2)已知:
Ⅰ.CaO(s)+H2SO4(l)![]() CaSO4(s)+H2O(l) ΔH=-271kJ·mol1
CaSO4(s)+H2O(l) ΔH=-271kJ·mol1
Ⅱ.5CaO(s)+3H3PO4(l)+HF(g)![]() Ca5(PO4)3F(s)+5H2O(l) ΔH=-937kJ·mol1
Ca5(PO4)3F(s)+5H2O(l) ΔH=-937kJ·mol1
则:①工业上用Ca5(PO4)3F和硫酸反应制备磷酸的热化学方程式为____________。
②一定条件下,在密闭容器中只发生反应Ⅱ,达到平衡后缩小容器容积,HF的平衡转化率________(填“增大”“减小”或“不变”,下同);HF的平衡浓度________。
(3)工业上用磷尾矿制备Ca5(PO4)3F时生成的副产物CO可用于制备H2,原理为CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH。
CO2(g)+H2(g) ΔH。
①一定温度下,向10L密闭容器中充入0.5mol CO和1mol H2O(g),2min达到平衡时,测得0~2min内用CO2表示的反应速率v(CO2)=0.02mol·L1·min1。则CO的平衡转化率α=________;该反应的平衡常数K=________。
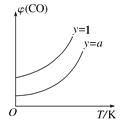
②在压强不变的密闭容器中发生上述反应,设起始的![]() =y,CO的平衡体积分数(φ)与温度(T)的关系如图所示。则:该反应的ΔH___0(填“>”“<”或“=”,下同)。a_____1,理由为_____________
=y,CO的平衡体积分数(φ)与温度(T)的关系如图所示。则:该反应的ΔH___0(填“>”“<”或“=”,下同)。a_____1,理由为_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com