
【题目】下列关于氧化还原反应的叙述正确的是
A.得到电子的物质被氧化
B.氧化还原反应中,一种元素被氧化,一定有另一元素被还原
C.含有化合价升高元素的反应物被氧化
D.氧化还原反应中,氧化剂和还原剂一定是两种物质
科目:高中化学 来源: 题型:
【题目】对于处于化学平衡状态的反应CO+H2O(g)![]() CO2+H2中,K正反应代表正反应的平衡常数,K逆反应代表逆反应的平衡常数,下列有关说法正确的是( )
CO2+H2中,K正反应代表正反应的平衡常数,K逆反应代表逆反应的平衡常数,下列有关说法正确的是( )
A. K正反应=K逆反应 B. K正反应>K逆反应
C. K正反应<K逆反应 D. K正反应×K逆反应=1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 写出镍原子的电子排布式_____________。
(2) 丙酮(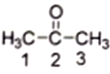 )分子中2号碳原子的杂化方式为__________;与CS2互为等电子体的阴离子是__________(写一种)。
)分子中2号碳原子的杂化方式为__________;与CS2互为等电子体的阴离子是__________(写一种)。
(3)含0.1mol[Cr(H2O)Cl]Cl2·H2O的水溶液与足量硝酸银溶液反应生成_______molAgCl沉淀。
(4)H2O分子的键角比H2S分子的键角大,原因是_______ 。
(5)N,P属于同族元素,但是它们的简单氢化物NH3,PH3在水中溶解度差异很大,其原因是 _________
(6) 由铜与氯形成的一种化合物的晶胞结构如图所示(黑点代表铜原子)。
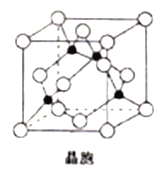
①该晶体的化学式为_______。
②将晶胞内的4个黑点相互连接所形成的立体构型是_______。
③晶体中与一个氯原子距离最近的氯原子有_______个。
④已知该晶体的密度为ρg.cm-3,阿伏加德罗常数的值为NA,则该晶体中铜原子和氯原子之间的最短距离为_______pm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质转化中,两种物质之间一步反应能实现的是
A. SiO2![]() 粗硅
粗硅![]() SiCl4
SiCl4![]() 高纯硅
高纯硅
B. NH3![]() NO
NO![]() NO2
NO2![]() 硝酸
硝酸
C. 海水![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液
MgCl2溶液![]() Mg
Mg
D. Fe3O4![]() Fe2 (SO4)3溶液
Fe2 (SO4)3溶液![]() FeSO4溶液
FeSO4溶液![]() FeSO4·7H2O
FeSO4·7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,能大量共存的是
A.Fe3+、I-、Cl-、Na+B.Cl-、K+、AlO2-、OH-
C.H+、Na+、K+、CO32-D.Ba2+、Mg2+、HCO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率的说法中,正确的是( )
A. 100mL2mol/L的盐酸与锌反应时,加入适量的硫酸钠溶液,生成氢气的速率不变
B. 用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率
C. 密闭容器中反应:N2(g)+3H2(g)![]() 2NH3(g),当温度、压强不变,充入惰性气体,反应速率减慢
2NH3(g),当温度、压强不变,充入惰性气体,反应速率减慢
D. 用铁片和稀硫酸反应制取氢气时,增大压强,反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应原子利用率最高的是
A. 工业制漂白粉2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
B. 工业制备钠2NaCl(熔融)![]() 2Na+Cl2↑
2Na+Cl2↑
C. 火法炼铜3Cu2S+3O2![]() 6Cu+3SO2
6Cu+3SO2
D. 现代石油工业采用银做催化剂生产环氧乙烷2CH2=CH2→![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X 均为中学常见的单质或化合物,它们之间有如下转化关系(副产物已略去)。 试回答:
![]()
(1)若 X 是气体单质,则 A 可能是_____.
a.C b.Al c.Na d.Fe
(2)若 X 是金属单质,向 C 的水溶液中滴加 AgNO3 溶液,产生不溶于稀 HNO3 的白色沉淀;X 在 A
中可以燃烧。
①B 的化学式为_____;C 溶液在贮存时应加入少量 X,理由是(用必要的文字和离子方程式 表示)_________。
②向 C 的溶液中加入氢氧化钠溶液,现象是_________;写出涉及到的氧化还原反应的 化学方程式_____。
(3)若 A、B、C 为含有同种金属元素的化合物,X 为强酸或强碱溶液,则 B 的化学式为_____; 反应②的离子方程式为__________________或________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com