
【题目】已知X、Y、Z三种元素均为短周期元素,原子序数依次递增,Q、W为前30号元素。5种元素的部分特点:
元素 | 特点 |
X | 其气态氢化物呈三角锥形,水溶液显碱性 |
Y | 基态原子核外有三个能级,其中最外层电子数等于次外层电子数的3倍 |
Z | 元素原子的外围电子层排布式为nsn-1npn-1 |
Q | 被誉为“太空金属”,也有“生物金属”之称,其基态原子次外层有2个未成对电子 |
W | 原子M能级层为全充满状态且核外的未成对电子只有一个 |
(1)XF3分子中X的杂化类型为______,该分子的空间构型为_______.
(2)基态Q原子的电子排布式为_____________________,第一电离能:X______Y(填“>” “<”或“=”) .
(3)X、Y、Z电负性由大到小的顺序为____________(用元素符号表示).
(4)Na在Y2中燃烧产物的电子式为________________.
(5)Z和X形成的化合物常用作高温耐火材料,化学性质稳定,据此推测它应属于_______晶体.
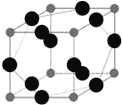
(6)W元素与X元素形成某种化合物的晶胞结构如图所示(黑球代表W原子),若该晶体的密度为ρ g·cm-3,则该晶胞的体积是__________cm3.
【答案】sp3 三角锥形 1s22s22p63s23p63d24s2 > O>N>Si ![]() 原子 206/(NA.ρ)
原子 206/(NA.ρ)
【解析】
X、Y、Z三种元素均为短周期元素,原子序数依次递增,Q、W为前30号元素,由X的气态氢化物呈三角锥形,水溶液显碱性,可知X为N元素;Y的基态原子核外有三个能级,其中最外层电子数等于次外层电子数的3倍,最外层电子数为6,可知Y为O元素;Z的外围电子层排布式为nsn-1npn-1,n-1=2,可知n=3,即外围电子层排布式为3s23p2,Z为Si元素;Q被誉为“太空金属”也有“生物金属”之称,其基态原子次外层有2个未成对电子,Q为Ti元素;W的原子M能级层为全充满状态且核外的未成对电子只有一个,电子排布为1s22s22p63s23p63d104s1,W为Cu元素,据此分析解答。
由上述分析可知,X为N元素、Y为O元素、Z为Si元素、Q为Ti元素、W为Cu元素。
(1)XF3分子中N原子上有1对孤对电子,形成3个N-F键,则X的杂化类型为sp3;空间构型为三角锥形,故答案为:sp3;三角锥形;
(2)Q为Ti元素,原子序数为22,基态Q原子的电子排布式为1s22s22p63s23p63d24s2;N的2p电子半满为稳定结构,则第一电离能X>Y,故答案为:1s22s22p63s23p63d24s2;>;
(3)非金属性越强,电负性越大,则X、Y、Z电负性由大到小的顺序为O>N>Si,故答案为:O>N>Si;
(4)Na在Y2中燃烧的产物为过氧化钠,属于离子化合物,含有离子键和非极性键,其电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(5)Z和X形成的化合物常用作高温耐火材料,化学性质稳定,可知熔点高,该化合物形成的晶体为原子晶体,故答案为:原子;
(6)黑球代表W原子,位于棱上,个数为12×![]() =3,N位于顶点,个数为8×
=3,N位于顶点,个数为8×![]() =1,化学式为Cu3N,该晶体的密度为ρ gcm-3,则该晶胞的体积是
=1,化学式为Cu3N,该晶体的密度为ρ gcm-3,则该晶胞的体积是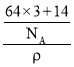 cm3=
cm3=![]() cm3,故答案为:
cm3,故答案为:![]() 。
。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值。下列说法错误的是
A.反应![]() 中,每生成294 g
中,每生成294 g![]() g释放的中子数为3NA
g释放的中子数为3NA
B.常温常压下,22.4 L乙烷和丙烯(C3 H6)的混合物中氢原子数目为6NA
C.1 L0.5 mol. L-1'碳酸钠溶液含有的CO32- 数目小于0.5NA
D.0.1 mol H2O2与MnO2充分作用生成O2,转移的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2O是黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会发生燃烧并爆炸。一种制取Cl2O的装置如图所示。
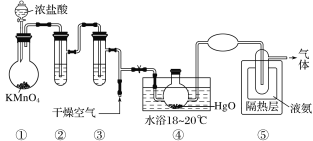
已知:Cl2O的熔点为-116℃,沸点为3.8℃;Cl2的沸点为-34.6℃;HgO+2Cl2=HgCl2+Cl2O。
下列说法中不正确的是( )
A.装置②③中盛装的试剂依次是饱和食盐水和浓硫酸
B.通入干燥空气的目的是将生成的Cl2O稀释,减小爆炸危险
C.从装置⑤中逸出气体的主要成分是Cl2
D.装置④与⑤之间不用橡胶管连接,是为了防止橡胶管燃烧和爆炸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某有机物分子的比例模型,有关该物质的推断不正确的是( )

A.分子中可能含有羟基
B.分子中可能含有羧基
C.分子中可能含有氨基
D.该物质的化学式可能为C3H6O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在烷烃分子中的基团:-CH3、-CH2-、![]() 、
、![]() 中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示。例如:
中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示。例如: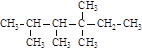 分子中,n1=6,n2=1,n3=2,n4=1。试根据不同烷烃的组成结构,分析出烷烃(除甲烷外)各原子数的关系。
分子中,n1=6,n2=1,n3=2,n4=1。试根据不同烷烃的组成结构,分析出烷烃(除甲烷外)各原子数的关系。
(1)烷烃分子中氢原子数n0与n1、n2、n3、n4之间的关系是n0=_________________。
(2)四种碳原子数之间的关系为n1=_________________________________________。
(3)若分子中n2=n3=n4=1,则该分子的结构简式可能为(任写一种)________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茉莉酸甲酯具有强烈而持久的茉莉花香,广泛用于人工配制的茉莉精油中,其结构简式如图所示。下列关于茉莉酸甲酯的说法中不正确的是( )
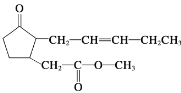
A.分子式为C13H20O3
B.茉莉酸甲酯易溶于水
C.能发生氧化、水解和加聚反应
D.分子中含2个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ⅢA族的硼、铝、镓、铟、铊等元素在化合物中通常表现出+3价,含ⅢA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题。
(1)基态Ga原子价层电子排布式_____。
(2)砷化镓属于第三代半导体,晶胞结构与金刚石相似。下列说法正确的是_____。
A.砷化镓晶胞结构中Ga原子的轨道杂化方式为sp3
B.第一电离能:As<Ga
C.电负性:As<Ga
D.砷和镓都属于p区元素
(3)BCl3的立体构型是____,由第二周期元素组成的与BCl3互为等电子体的阴离子为____。
(4)已知:Al的燃烧热为△H1=akJ·mol-1;Fe2O3(s)+2Al(s)=Al2O3(s)+2Fe(s);ΔH2=bkJ/mol,则:3O2(g)+4Fe(s)=2Fe2O3(s);ΔH3=____kJ/mol。
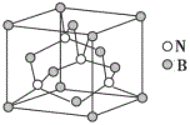
(5)人造立方氮化硼晶胞如图所示,判断该晶体结构中存在配位键的依据是____。设该晶体的摩尔质量为Mg/mol,晶体的密度为ag/cm3,阿伏加德罗常数的值为NA,则晶体中两个距离最近的B原子之间的距离为____cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】呋喃酚是合成农药的重要中间体,其合成路线如下:
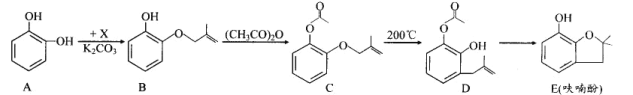
(1)A 物质核磁共振氢谱共有___________个峰,B→C 的反应类型是_____;E 中含有 的官能团名称是_____,D不能够发生的反应有_________(填代号)。
①氧化反应 ②取代反应 ③加成还原 ④消去反应
(2)已知 X 的分子式为 C4H7Cl,写出 A→B 的化学方程式:_____________。
(3)Y 是 X 的同分异构体,分子中无支链且不含甲基,则 Y 的名称(系统命名)是 ________。
(4)下列有关化合物 C、D 的说法正确的是_____________。
①可用氯化铁溶液鉴别 C 和 D ②C、D 含有的官能团完全相同
③C、D 互为同分异构体 ④C、D 均能使溴水褪色
(5)E 的同分异构体很多,写出符合下列条件的芳香族同分异构体的结构简式:____________。
①环上的一氯代物只有一种 ②含有酯基 ③能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯酚![]() 在一定条件下能与H2加成得到环己醇
在一定条件下能与H2加成得到环己醇![]() 。下面关于这两种物质的叙述中,错误的是
。下面关于这两种物质的叙述中,错误的是
A. 常温时在水中的溶解性都比乙醇差
B. 都能与金属Na、K等金属反应放出氢气
C. 都显弱酸性,且酸性都弱于碳酸
D. 苯酚与FeCl3溶液作用显紫色,环己醇加入FeCl3溶液,液体分层,上层无色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com