
【题目】已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol;Na2O2(s)+CO2(g)=Na2CO3(s)+![]() O2(g) ΔH=-226 kJ/mol,根据以上热化学方程式判断下列说法正确的是( )
O2(g) ΔH=-226 kJ/mol,根据以上热化学方程式判断下列说法正确的是( )

A.CO的燃烧热为283 kJ
B.如图所示为CO生成CO2的反应过程和能量的关系
C.2Na2O2(s)+2CO2(s) =2Na2CO3(s)+O2(g)ΔH>-452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,转移电子数为6.02×1023
【答案】C
【解析】
A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量,单位为kJ/mol,根据反应2CO(g)+O2(g)=2CO2(g)ΔH=-566 kJ/mol可得,CO的燃烧热为![]() kJ/mol =283kJ/mol,故A错误;
kJ/mol =283kJ/mol,故A错误;
B.图中的焓变应是2molCO燃烧的反应热,图中物质的量和焓变不统一,故B错误;
C.根据Na2O2(s)+CO2(g)=Na2CO3(s)+![]() O2(g)△H=-226kJ/mol可知,2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g) △H=-452kJ/mol<0,由CO2(s)转化为CO2(g)为吸热过程,则2Na2O2(s)+2CO2(s) =2Na2CO3(s)+O2(g)ΔH>-452 kJ/mol,故C正确;
O2(g)△H=-226kJ/mol可知,2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g) △H=-452kJ/mol<0,由CO2(s)转化为CO2(g)为吸热过程,则2Na2O2(s)+2CO2(s) =2Na2CO3(s)+O2(g)ΔH>-452 kJ/mol,故C正确;
D.已知①2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol、②Na2O2(s)+CO2(g)=Na2CO3(s)+![]() O2(g)△H=-226kJ/mol,依据盖斯定律②×2+①可得:2Na2O2(s)+2CO(g)=2Na2CO3(s) △H=-1018kJ/mol,即:Na2O2(s)+CO(g)=Na2CO3(s) △H=-509kJ/mol,则CO(g)与Na2O2(s)反应放出509kJ热量时消耗1molCO,转移了2mol电子,电子转移数为2×6.02×l023,故D错误;
O2(g)△H=-226kJ/mol,依据盖斯定律②×2+①可得:2Na2O2(s)+2CO(g)=2Na2CO3(s) △H=-1018kJ/mol,即:Na2O2(s)+CO(g)=Na2CO3(s) △H=-509kJ/mol,则CO(g)与Na2O2(s)反应放出509kJ热量时消耗1molCO,转移了2mol电子,电子转移数为2×6.02×l023,故D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】25℃时,向10mL0.1mol·L-1一元弱碱XOH溶液中逐滴滴加0.1mol·L-1的HCl溶液,溶液的AG[AG=lg![]() ]变化如图所示(溶液混合时体积变化忽略不计)。下列说法正确的是
]变化如图所示(溶液混合时体积变化忽略不计)。下列说法正确的是
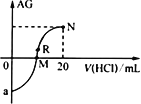
A.若a=-8,则25℃时,0.1mol·L-1XOH溶液的pH=8
B.M点表示盐酸和XOH恰好完全反应
C.R点溶液中可能存在c(X+)+c(XOH)=c(Cl-)
D.M点到N点,水的电离程度逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 18g氨基(-ND2)中含有的电子数为10NA
B. 一定质量的乙烷与22.4L(标准状况)Cl2在光照条件下发生取代反应,形成C-Cl键的数目为2NA
C. 用惰性电极电解100mL0.1mol·L-1的CuSO4溶液,当阴、阳两极产生相同条件下等体积的气体时,电路中转移电子数为0.04NA
D. n(H2SO3)和n(HSO3-)之和为1mol的KHSO3溶液中,含有的K+数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠(Na2MoO4)是一种新型阻燃剂和水处理剂。从一种含钼的废弃催化剂(主要成分为MoO3、Al2O3、Fe2O3等)中可回收Na2MoO4,其工艺流程如下:
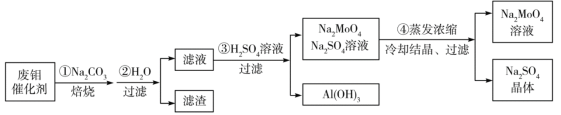
已知:MoO3,Al2O3与SiO2相似,均能在高温下与Na2CO3发生类似反应。
下列有关叙述错误的是
A.焙烧时发生反应之一:Al2O3+Na2CO3=2NaAlO2+CO2↑
B.用硫酸浸取②操作后所得滤渣并加入KSCN,溶液变为血红色
C.步骤③中可以用CO2代替硫酸
D.步骤④中可知Na2MoO4溶解度随温度变化较小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明金属铁能与N2O、CO反应,其反应的能量变化与反应进程如图所示,下列说法不正确的是( )
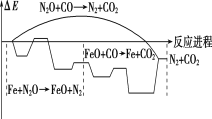
A.总反应为放热反应
B.加入铁,可使反应的焓变减小
C.Fe是该反应的催化剂
D.Fe+N2O→FeO+N2,FeO+CO→Fe+CO2两步反应均为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性条件下,黄铁矿(FeS2)催化氧化的反应方程式为2FeS2 + 7O2+ 2H2O ═ 2Fe2+ + 4SO42 + 4H+实现该反应的物质间转化如图所示。下列分析正确的是

A.反应Ⅰ的离子方程式为4Fe(NO)2+ + O2+ 4H+ ═ 4Fe3+ +4NO + 2H2O,Fe(NO)2+作氧化剂
B.反应Ⅱ中Fe3+作氧化剂,FeS2被还原
C.在酸性条件下,黄铁矿催化氧化中NO作催化剂
D.反应Ⅲ的离子方程式为Fe2+ + NO ═Fe(NO)2+,该反应是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氯化铜[CuaClb(OH)cH2O]是一种重要的无机杀虫剂,它可以通过以下步骤制备。步骤1:将铜粉加入稀盐酸中,并持续通空气反应后生成CuCl2。已知Fe3+对该反应有催化作用,其催化原理如图所示

步骤2:在制得的CuCl2溶液中,加入石灰乳充分反应后即可制备碱式氯化铜。下列有关说法正确的是( )
A.a、b、c之间的关系式为:a=b+c
B.图中M、N分别为Fe2+、Fe3+
C.步骤1充分反应后,加入CuO是为了除去Fe3+
D.若制备1molCuCl2,理论上消耗11.2LO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向甲乙两个容积均为1L的恒容容器中,分别充入2moLA、2molB和1molA、1molB.相同条件下,发生下列反应:A(g)+B(g)![]() xC(g)ΔH<0.测得两容器中c(A)随时间t的变化如图所示:下列说法正确的是
xC(g)ΔH<0.测得两容器中c(A)随时间t的变化如图所示:下列说法正确的是
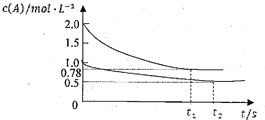
A.x可能等于2也可能等于3
B.向平衡后的乙容器中充入氦气可使c(A)增大.
C.向甲容器中再充入2molA、2molB,则平衡时甲容器中0.78mol·L-1<c(A)<1.56mol·L-1
D.将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用.制备纳米TiO2的方法之一是TiCl4水解生成TiO2xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2.用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.请回答下列问题:
(1)TiCl4水解生成TiO2x H2O的化学方程式为____________________________________.
(2)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是__________________;使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要如图中的______(填字母代号)

(3)滴定分析时,称取TiO2(摩尔质量为M gmol-1)试样w g,消耗c molL-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为______.
(4)判断下列操作对TiO2质量分数测定结果的影响(填 “偏高”、“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果______.
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com