
【题目】医药阿斯匹林的结构简式如图。试回答:
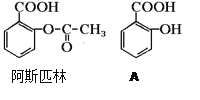
(1)阿斯匹林可看成酯类物质,口服后在胃肠作用下,阿斯匹林发生水解反应,生成A和B两种产物。其中A的结构简式如图,则阿斯匹林的分子式为:______________B的结构简式为:_______B中的官能团是:______________(名称)
⑵上述水解产物B与甲醇、浓硫酸共热反应的化学方程式为:_____________________________________________________
⑶ 甲醇在铜作催化剂时与氧气反应的化学方程式为:______________________________
科目:高中化学 来源: 题型:
【题目】如图所示,隔板I固定不动,活塞II可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)![]() xC(g),向M、N中通入1mol和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是( )
xC(g),向M、N中通入1mol和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是( )

A. 若x=3,达到平衡后A的体积分数关系为:![]()
B. 若x<3,C的平衡浓度关系为:c(M)<c(N)
C. 若x>3,达到平衡后B的转化率关系为:![]()
D. x不论为何值,平衡时M、N中的平均相对分子质量都相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10月27日,国际清洁能源会议(ICCE2019)在北京开幕,一碳化学成为这次会议的重要议程。甲醇、甲醛(HCHO)等一碳化合物在化工、医药、能源等方面都有广泛的应用。
(1)甲醇脱氢法可制备甲醛(反应体系中各物质均为气态),反应生成1mol HCHO过程中能量变化如图:
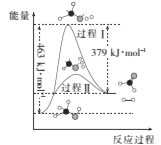
已知:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) H=-49.5kJ/mol
则反应CO2(g)+2H2(g)=HCHO(g)+H2O(g) H=______kJ/mol
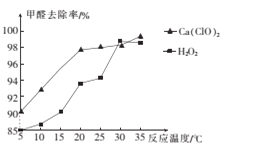
(2)氧化剂可处理甲醛污染,结合图象分析春季(水温约为15℃)应急处理被甲醛污染的水源应选择的试剂为____(填化学式)。
(3)纳米二氧化钛催化剂可用于工业上合成甲醇:CO(g)+2H2(g)CH3OH(g) H=akJ/mol
①按![]() =2投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图所示。则a ___(填“>”或“<”)0;压强p1、p2、p3由小到大的关系是______。
=2投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图所示。则a ___(填“>”或“<”)0;压强p1、p2、p3由小到大的关系是______。
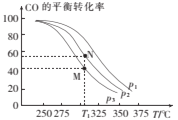
②在温度为T1℃,向某恒容密闭容器中充入H2和CO发生上述反应,起始时c(H2)=c(CO)=2.0mol/L。达到平衡时,CO的转化率为图中的M点对应的转化率,则在该温度下,对应的N点的平衡常数为______(保留3位有效数字)。
(4)工业上利用CH4(混有CO和H2)与水蒸气在一定条件下制取H2,该反应的逆反应速率表达式为v逆=kc(CO)c3(H2),k为速率常数,在某温度下测得实验数据如表所示:
CO浓度(mol/L) | H2浓度(mol/L) | 逆反应速率(mol·L-1·min-1) |
0.1 | c1 | 8.0 |
c2 | c1 | 16.0 |
c2 | 0.15 | 6.75 |
由上述数据可得该温度下,c2=_____,该反应的逆反应速率常数k=____L3mol-3min-l。
(5)用甲醇可以制备甲胺(CH3NH2),甲胺在水中的电离方程式与氨相似。25℃时,甲胺的电离常数Ka=9.25×10-7。该温度下,反应CH3NH2+H+![]() CH3NH3+的平衡常数K= ___(填数值)。
CH3NH3+的平衡常数K= ___(填数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合K时,观察到电流表的指针发生了偏移。
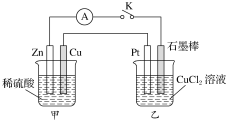
请回答下列问题:
(1)甲装置的名称是________;乙装置的名称是________;Zn极为________极;Pt极为______极。
(2)写出电极反应式:Cu极_____________;石墨棒极____________。
(3)当甲中产生![]() 气体时,乙中析出铜的质量应为________;乙中产生的气体在标准状况下的体积应为________。
气体时,乙中析出铜的质量应为________;乙中产生的气体在标准状况下的体积应为________。
(4)若乙中溶液不变,将其电极都换成铜电极,闭合K一段时间后,乙中溶液的颜色________(填“变深”、“变浅”或“无变化”)。
(5)若乙中电极不变,将其溶液换成![]() 溶液,闭合K一段时间后,甲中溶液的pH将________(填“增大”、“减小”或“不变”,下同);乙中溶液的pH将_______。
溶液,闭合K一段时间后,甲中溶液的pH将________(填“增大”、“减小”或“不变”,下同);乙中溶液的pH将_______。
(6)若乙中电极不变,将其溶液换成饱和![]() 溶液,闭合K一段时间,当阴极上有
溶液,闭合K一段时间,当阴极上有![]() 气体生成时,同时有
气体生成时,同时有![]() 析出,假设温度不变,剩余溶液中溶质的质量分数应为_____(用含w、a的代数式表示,不必化简)。
析出,假设温度不变,剩余溶液中溶质的质量分数应为_____(用含w、a的代数式表示,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用固体燃料电池技术处理 H2S废气并发电的原理如图所示 。根据不同固体电解质M因传导离子的不同,分为质子传导型和氧离子传导型,工作温度分别为 500℃和 850℃左右,传导质子时的产物硫表示为Sx。下列说法错误的是
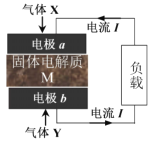
A.气体X 是H2S废气,气体Y 是空气
B.M传导质子时,负极a 反应为:xH2S—2xe-=Sx+2xH+
C.M传导氧离子时,存在产生SO2污染物的问题
D.氧离子迁移方向是从a 电极向b 电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在城市中地下常埋有纵横交错的管道和输电线路,有些地面上还铺有地铁或城铁的铁轨,当有电流泄漏入潮湿的土壤中,并与金属管道或铁轨形成回路时,就会引起后者的腐蚀。原理简化如图所示。则下列有关说法不正确的是
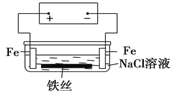
A.原理图可理解为两个串联电解装置
B.溶液中铁丝被腐蚀时,左侧有无色气体产生,附近产生少量白色沉淀,随后变为灰绿色
C.溶液中铁丝左端电极反应式为:Fe-2e-=Fe2+
D.地下管线被腐蚀,不易发现,维修也不便,故应将埋在地下的金属管道表面涂绝缘膜(或油漆等)
查看答案和解析>>
科目:高中化学 来源: 题型:
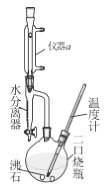
【题目】正丁醚可作许多有机物的溶剂及萃取剂 ,常用于电子级清洗剂及用于有机合成 。实验室用正丁醇与浓H2SO4反应制取,实验装置如右图,加热与夹持装置略去。反应原理与有关数据:
反应原理: 2C4H9OH ![]() C4H9OC4H9+H2O
C4H9OC4H9+H2O
副反应:C4H9OH![]() C2H5CH=CH2+H2O
C2H5CH=CH2+H2O
物质 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | ||
水 | 50%硫酸 | 其它 | ||||
正丁醇 | 74 | -89.8 | 117.7 | 微溶 | 易溶 | 二者互溶 |
正丁醚 | 130 | -98 | 142.4 | 不溶 | 微溶 | |
实验步骤如下:
①在二口烧瓶中加入0.34mol正丁醇和4.5mL浓H2SO4,再加两小粒沸石,摇匀。
②加热搅拌,温度上升至100~ll0℃开始反应。随着反应的进行,反应中产生的水经冷凝后收集在水分离器的下层,上层有机物至水分离器支管时,即可返回烧瓶。加热至反应完成。
③将反应液冷却,依次用水、50%硫酸洗涤、水洗涤,再用无水氯化钙干燥,过滤,蒸馏,得正丁醚的质量为Wg。
请回答:
(1)制备正丁醚的反应类型是____________,仪器a的名称是_________。
(2)步骤①中药品的添加顺序是,先加______(填“正丁醇”或“浓H2SO4”),沸石的作用是___________________。
(3)步骤②中为减少副反应,加热温度应不超过_________℃为宜。使用水分离器不断分离出水的目的是________。如何判断反应已经完成?当_____时,表明反应完成,即可停止实验。
(4)步骤③中用50%硫酸洗涤的目的是为了除去______________。本实验中,正丁醚的产率为_____(列出含W的表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL某混合液中,硝酸和硫酸的物质量浓度分别是0.4mol·L-1,0.1mol·L-1,向该混合液中加入1.92g铜粉,加热,待充分反应后,所得溶液中铜离子物质量浓度是( )
A.0.15 mol·L-1B.0.225 mol·L-1C.0.35 mol·L-1D.0.45 mol·L
查看答案和解析>>
科目:高中化学 来源: 题型:
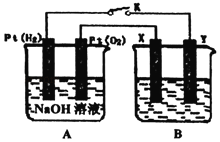
【题目】某化学兴趣小组用如图所示装置进行电化学原理的实验探究,冋答下列问题:
(1)通入O2的Pt电极为电池的_____(填“正极”或“负极”),电极反应式为_____。
(2)若B电池为电镀池,目的是在某镀件上镀一层银,则X电极材料为_____(填“镀件”或“银”)。
(3)若B电池的电解质溶液为500mL1.0molL﹣1的NaCl溶液(滴有少量紫色石蕊试液),X、Y皆为惰性电极,电池工作过程中发现X极溶液先变红后局部褪色,解释原因_____。当电池工作一段时间后断开K,Y极共收集到560mL气体(标准状况),此时B池中溶液的pH=_____(假设溶液体积不变),转移电子的数目为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com