
| A、CxHy |
| B、CxHy -x |
| C、CxH2y-2x |
| D、CxHy-2x |
| P |
| R |
| V |
| T |
| V |
| T |
| P |
| R |
| V |
| T |
| V |
| T |
| 546K |
| 273K |
| 546K |
| 273K |
| 2xL |
| 2L |
| 2(y-2x)L |
| 2L |


科目:高中化学 来源: 题型:
| A、CO--酸性氧化物 Na2O2--碱性氧化物 Al2O3--两性氧化物 |
| B、漂白粉--混合物 胆矾--纯净物 HD--单质 |
| C、纯碱--碱 硫化氢--酸 小苏打--酸式盐 |
| D、盐酸--强电解质 硫酸钡--强电解质 醋酸--弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
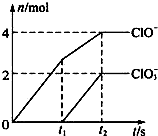 向一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中有三种含氯元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.已知,生成ClO3-的反应为:6Ca(OH)2+6Cl2
向一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中有三种含氯元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.已知,生成ClO3-的反应为:6Ca(OH)2+6Cl2
| ||
| n(ClO-) | ||
n(Cl
|
| n(ClO-) | ||
n(Cl
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫化亚铁溶于稀硝酸中:FeS+2H+═Fe2++H2S↑ |
| B、少量CO2通入硅酸钠溶液中:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3- |
| C、含等物质的量的KHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
| D、硫化钠水溶液呈碱性:S2-+2H2O?H2S+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | C |
| 性质结构信息 | 单质在氯气中燃烧火焰呈黄色并产生大量白烟,所得产物的阳离子与D的阳离子电子数相同. | 单质是带有金属光泽的灰黑色固体,是信息技术的关键材料. | 最高价氧化物的水化物与其气态氢化物反应得到离子化合物D. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 性质或原子结构 |
| A | 原子核内只有一个质子 |
| B | 单质是空气中含量最多的气体 |
| X | 原子的最外层电子数是次外层电子数的3倍 |
| Y | 短周期元素中原子半径最大的元素 |
| Z | 最高正化合价与最低负化合价的代数和为6 |
| 实验操作 | 实验现象 | 结论及解释 |
| ①取少量NaBr 溶液于试管中,滴加 ②再加入少量CCl4,振荡,静置. | ①溶液由无色变为橙黄色. ②溶液分层, | 氧化性:Z 单质>Br2 离子方程式 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com