
����Ŀ���ǰ�(NH2OH)��ˮ��Һ�еĵ��뷽��ʽΪ��NH2OH+H2O![]() NH3OH++OH-����0.1mol/L����ζ�20mL0.1mol/L NH2OH��Һ���㶨25��ʱ���ζ���������ˮ���������OH-Ũ�ȵĸ���������������Ĺ�ϵ��ͼ��ʾ������˵��������ǣ� ��
NH3OH++OH-����0.1mol/L����ζ�20mL0.1mol/L NH2OH��Һ���㶨25��ʱ���ζ���������ˮ���������OH-Ũ�ȵĸ���������������Ĺ�ϵ��ͼ��ʾ������˵��������ǣ� ��
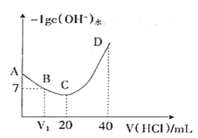
A.A��D��Һ�У�NH2OH���볣������
B.��A��D��ˮ�������c(OH-)��С
C.B���Ӧ����Һ��c(Cl-)=c(NH3OH+)
D.C���Ӧ����Һ��c(H+)=c(OH-)+ c(NH2OH)
���𰸡�B
��������
A. ƽ�ⳣ��ֻ���¶��йأ������¶Ȳ�����볣�����䣬A��ȷ��
B. ��ͼ��֪��C��-lgc(OH-)ֵ��С����ˮ�������c(OH-)���������A��D��ˮ�������c(OH-)�������ټ�С��B����
C. B���Ӧ����Һ�У�-lgc(OH-)=7����ˮ���������c(H+)=c(OH-)=10-7��������Һ�����ԣ�c(H+)=c(OH-)�����ݵ���غ㣺c(NH3OH+) +c(H+)= c(Cl-) +c(OH-)�����c(NH3OH+) = c(Cl-)��C��ȷ��
D. C���Ӧ����Һ�У�������NH2OH��Һǡ����ȫ��Ӧ����ǿ��������NH3OHCl��NH3OHClˮ������NH2OH����Һ�����ԣ����������غ㣺c(Cl-)=(NH3OH+)+c(NH2OH)������غ㣺c(NH3OH+) +c(H+)= c(Cl-) +c(OH-)����ʽ��ӿɵã�c(H+)=c(OH-)+ c(NH2OH)��D��ȷ��
��ѡB��


 ��ĩ1�����ʽ���������ϵ�д�
��ĩ1�����ʽ���������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ��3X(g)��Y(g) ![]() 2Z(g)��2W(g)��2 L�ܱ������н��У�5 min��Y������0.5 mol����˷�Ӧ�ķ�Ӧ����Ϊ(����)
2Z(g)��2W(g)��2 L�ܱ������н��У�5 min��Y������0.5 mol����˷�Ӧ�ķ�Ӧ����Ϊ(����)
A.v(X)��0.05 mol��L��1��min��1B.v(Y)��0.10 mol��L��1��min��1
C.v(Z)��0.10 mol��L��1��min��1D.v(W)��0.10 mol��L��1��s��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������̿�(��Ҫ�ɷ�MnO2)�ͻ�����(��Ҫ�ɷ�FeS2)��ȡMnSO4��H2O�����յ�����Ĺ����������£�
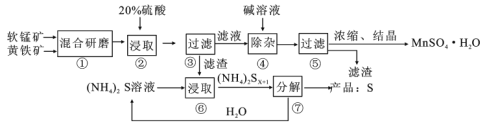
(1)����ٻ����ĥ��ϸ�۵���ҪĿ����__________������ڽ�ȡʱ������S��MnSO4��Fe2(SO4)3����Ӧ�����ӷ���ʽΪ___________��
(2)���������������Һ���ܺ���Fe2+������Fe2���ķ�����________����ȥFe2+�ķ�����__________����������ƻ�Fe(OH)3���岢ʹ�������������ڹ��˷��롣�������������Ϊ___________(�ѧʽ)��
(3)���������90��100���½��У��÷�Ӧ�Ļ�ѧ����ʽΪ___________��
(4)���ˮ������ӷ���ʽΪ��S2-��![]() ��H2O
��H2O![]() HS-��NH3��H2O������ж���Һ�������______��
HS-��NH3��H2O������ж���Һ�������______��
(5)�ⶨ��ƷMnSO4��H2O�ķ���֮һ�ǣ�ȷ��ȡa g��Ʒ����ƿ�У���������ZnO��H2O��У�Ȼ����c mol��L-1 KMnO4����Һ�ζ���dz��ɫ�Ұ���Ӳ��ʣ����ı���ҺV mL���ζ���Ӧ�����ӷ���ʽΪ2![]() ��3Mn2+��2H2O��5MnO2����4H+����Ʒ��Mn2+����������Ϊ��(Mn2+)��___________��
��3Mn2+��2H2O��5MnO2����4H+����Ʒ��Mn2+����������Ϊ��(Mn2+)��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������̼�IJ������������ҹ���Դ�����һ����Ҫս�Է���
��1����ѧ�������CO2��ȡC��̫���ܹ�����ͼ��ʾ��

����������ϵͳ�������ķ�Ӧ��n(FeO)/n(CO2)=6����FexOy�Ļ�ѧʽΪ____________��
�ڡ��ȷֽ�ϵͳ����ÿ�ֽ�1mol FexOy��ת�Ƶ��ӵ����ʵ���Ϊ________��
��2����ҵ����CO2��H2��Ӧ�ϳɶ����ѡ���֪��CO2(g)+ 3H2(g)�TCH3OH(g)+ H2O(g) ��H1=-53.7kJ/mol��CH3OCH3(g)+H2O(g) �T 2CH3OH(g) ��H2=+23.4kJ/mol����2CO2(g)+ 6H2(g)![]() CH3OCH3(g)+3H2O(g) ��H3=______kJ/mol��
CH3OCH3(g)+3H2O(g) ��H3=______kJ/mol��
��һ�������£������ϳɼ��ѵķ�Ӧ�ﵽƽ��״̬�����ı䷴Ӧ��ijһ�����������б仯��˵��ƽ��һ��������Ӧ�����ƶ�����_____������ţ���
a���淴Ӧ������������С b��H2��ת��������
c����Ӧ�������ٷֺ�����С d�������е�nCO2/nH2ֵ��С
����ijѹǿ�£��ϳɼ��ѵķ�Ӧ�ڲ�ͬ�¶ȡ���ͬͶ�ϱ�ʱ��CO2��ת������ͼ��ʾ��T1�¶��£���6 mol CO2��12molH2����2L���ܱ������У�5 min��Ӧ�ﵽƽ��״̬����0��5min�ڵ�ƽ����Ӧ����v(CH3OCH3) =___��KA��KB��KC����֮��Ĵ�С��ϵΪ_____��
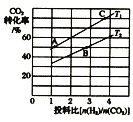
��3�������£��ð�ˮ����CO2�ɵõ�NH4HCO3��Һ����NH4HCO3��Һ�У�c (NH4+)_____c(HCO3��)���>������<����=��������ӦNH4++HCO3��+H2O![]() NH3��H2O+H2CO3��ƽ�ⳣ��K=__________________������֪������NH3��H2O�ĵ���ƽ�ⳣ��Kb=2��10-5��H2CO3�ĵ���ƽ�ⳣ��K1=4��10-7mol��L-1��K2=4��10-11mol��L-1��
NH3��H2O+H2CO3��ƽ�ⳣ��K=__________________������֪������NH3��H2O�ĵ���ƽ�ⳣ��Kb=2��10-5��H2CO3�ĵ���ƽ�ⳣ��K1=4��10-7mol��L-1��K2=4��10-11mol��L-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������( ![]() )��һ�ֿ�����ɭ�ϲ�ҩ�������������͵�һ�ֺϳ�·��(
)��һ�ֿ�����ɭ�ϲ�ҩ�������������͵�һ�ֺϳ�·��( ![]() ��дΪBnCl��
��дΪBnCl�� ![]() ��дΪCbzCl )��
��дΪCbzCl )��

�ش��������⣺
��1����Ӧ�ٵķ�Ӧ����Ϊ_________��������Ϊ_____________��
��2����������������ķǺ�������������Ϊ_______________��������ͷ�������_____������̼ԭ�ӡ�
��3����Ӧ��Ϊ�ӳɷ�Ӧ�����л���X������Ϊ________________��
��4��![]() ��________�ԣ���ᡱ�����С������
��________�ԣ���ᡱ�����С������
��5��![]() ��ͬ���칹���У�����NaHCO3��Һ��Ӧ����CO2�Ķ�ȡ�����㻯������_____�֣����к˴Ź�������Ϊ�����Ľṹ��ʽΪ___________________________��
��ͬ���칹���У�����NaHCO3��Һ��Ӧ����CO2�Ķ�ȡ�����㻯������_____�֣����к˴Ź�������Ϊ�����Ľṹ��ʽΪ___________________________��
��6�����������ϳ�·�ߣ��Զ��ǻ�����ȩΪԭ��(���Լ���ѡ)������Ʊ����ǻ�������ĺϳ�·�ߣ� __________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ӵĽṹʽΪ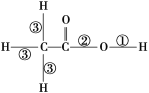 �����з�Ӧ���ϼ���λ��ȷ����
�����з�Ӧ���ϼ���λ��ȷ����
������ĵ��룬�Ǣټ�����
���������Ҵ�����������Ӧ���Ǣڼ�����
���ں��״���ʱ��Br2��CH3COOH�ķ�Ӧ��CH3COOH+Br2![]() CH2Br��COOH+HBr���Ǣۼ�����
CH2Br��COOH+HBr���Ǣۼ�����
���������������ķ�Ӧ��2CH3COOH��![]() ���Ǣ٢ڼ�����
���Ǣ٢ڼ�����
A. �٢ڢ� B. �٢ڢۢ� C. �ڢۢ� D. �٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
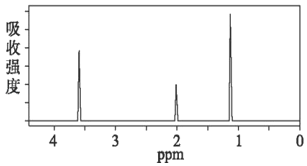
����Ŀ��ȡ0.92 g��C��H��O����Ԫ����ɵ��л���A����������������ȫȼ�գ�����ȼ�ղ���ͨ����ʯ�ң���ʯ����������2.84 g������ȼ�ղ���ͨ��Ũ���ᣬŨ������������1.08 g����֪��A������������������ܶ�Ϊ23��
��1��A�ķ���ʽ��_____��
��2��A��1H�˴Ź�����ͼ��ͼ��ʾ��д����ṹ��ʽ��_____������һ��ͬ���칹��Ľṹ��ʽΪ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���Ӧ���������������
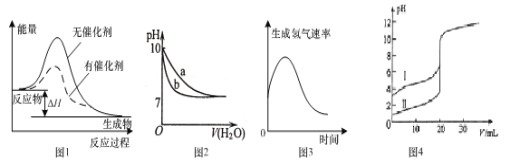
A.ͼ1��ʾij���ȷ�Ӧ�ֱ����С�����������·�Ӧ�����е������仯
B.ͼ2��ʾ��ͬ�¶��£���pH=10������������Һ�Ͱ�ˮ�зֱ��ˮϡ��ʱpH�仯���ߣ�����b��ʾ��ˮϡ��ʱpH�ı仯����
C.ͼ3��ʾþ��������������������������ʱ��ı仯�������Ӧ���ʼӿ��ԭ�����Ǹ÷�ӦΪ���ȷ�Ӧ
D.ͼ4��ʾ�����£���0.l00mol ��L��1NaOH��Һ�ֱ�ζ�20.00 mL 0.100 mol ��L��1������ʹ��ᣬ����I��ʾ���ǵζ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ž��з���Ƶ�һ��Ԫ��������������������ε��ݱ䣬�����˶�����ʽ��Ԫ�����ڱ������ʾ�Ĺ����ڶ���Ƿ�������Ҫ���á��±���Ԫ�����ڱ��в��ֶ���������Ԫ�ص��й���Ϣ��
Ԫ�ر�� | Ԫ�����ʻ�ԭ�ӽṹ |
T | ������ 5 �ֲ�ͬ�����ĵ��ӣ���������� 2 �ԳɶԵ��� |
X | ����ϼ�Ϊ+7 �� |
Y | ����������Ԫ��ԭ���а뾶��� |
Z | ����������Ӧˮ����������� |
��1����������Ԫ���У�������ӵİ뾶��С����________�������ӷ��ţ���
��2��T �� X ��Ӧ��Ԫ�أ�����̬�⻯���ȶ��Խ�ǿ����_______���ѧʽ����
��3����ԭ�ӽṹ��֪ʶ��˵�� T �� X ��ӦԪ�صķǽ����Ե����ǿ������ T ��ӦԪ�ص���̬�⻯���ˮ��Һ�еμ� X ���ʵ�ˮ��Һ��������_______��д����Ӧ�����ӷ���ʽ _______��
��4��Y �� Z ��ӦԪ�أ�������������Ӧˮ����ɷ�����Ӧ��д���÷�Ӧ�����ӷ���ʽ________��
��5������ Z ��ӦԪ�صĵ��ʣ�����������Ӧ��ұ����������Ӧ��������11.2g���ʣ���ת�Ƶ��ӵ���ĿΪ___��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com