
【题目】溶液中存在电离平衡、水解平衡、沉淀溶解平衡等多种形式的化学平衡。
(1)常温下,用0.10molL-1NaOH溶液滴定20.00mL0.10molL-1CH3COOH溶液,滴定曲线如图所示。
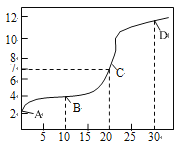
①B点所示的溶液中:c(Na+)+c(H+)_____c(CH3COOH)+c(OH-)(填“>”、“=”或“<“)。
②C点为理论上的反应终点,则该滴定实验应选用的指示剂是____,此时溶液的pH大于7,原因是____(用化学用语表示)。
③点D所示溶液中c(H+)、c(OH-)、c(CH3COOH)、c(CH3COO-)四者之间的等量关系式为:c(OH-)-c(H+)=______。
(2)已知常温时Ksp[Al(OH)3]=1×10-33,Ksp[Mg(OH)2]=5.6×10-12,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.9×10-5。
①常温下,某溶液中c(Mg2+)=5.6mol/L,欲除去该溶液中的Al3+(使其浓度小于1×10-5mol/L),需要调节pH的范围为______<pH<_____。
②常温下,CaSO4(s)+CO32-(aq)![]() CaCO3(s)+SO42-(aq)平衡常数的值为_______。
CaCO3(s)+SO42-(aq)平衡常数的值为_______。
【答案】> 无色酚酞试液 CH3COO-+H2O![]() CH3COOH+OH- 1.5c(CH3COOH)+0.5c(CH3COO-) 4.7 8 1.75×104
CH3COOH+OH- 1.5c(CH3COOH)+0.5c(CH3COO-) 4.7 8 1.75×104
【解析】
(1)①B点溶液中溶质为CH3COOH和CH3COONa,且n(CH3COOH):n(CH3COONa)=1:1,此时溶液显酸性,说明CH3COOH的电离程度大于CH3COO-的水解程度,则c(CH3COOH) <c(CH3COO-),由溶液中的电荷守恒式可知c(Na+)+c(H+)= c(CH3COO-)+c(OH-)>c(CH3COOH)+c(OH-);
②C点恰好完全反应生成CH3COONa,CH3COO-水解使溶液显碱性,则用NaOH溶液滴定CH3COOH溶液时应选择无色酚酞试液作指示剂;滴定终点时溶液的pH大于7,原因是CH3COO-水解,发生的水解反应式为CH3COO-+H2O![]() CH3COOH+OH-;
CH3COOH+OH-;
③D点溶液中溶质为NaOH和CH3COONa,且n(NaOH):n(CH3COONa)=1:2,此时溶液中的电荷守恒式为c(Na+)+c(H+)= c(CH3COO-)+c(OH-),物料守恒式为c(Na+)= 1.5c(CH3COOH) +1.5c(CH3COO-),则c(OH-)-c(H+)= c(Na+)- c(CH3COO-)=1.5c(CH3COOH) +1.5c(CH3COO-)- c(CH3COO-)=1.5c(CH3COOH)+0.5c(CH3COO-);
(2)①已知Ksp[Al(OH)3]=1×10-33,则Al3+沉淀完全时c(OH-)=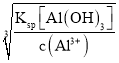 =
=![]() mol/L=
mol/L=![]() mol/L,此时溶液的pH≈4.7,Ksp[Mg(OH)2]=5.6×10-12,则Mg2+开始沉淀时c(OH-)=
mol/L,此时溶液的pH≈4.7,Ksp[Mg(OH)2]=5.6×10-12,则Mg2+开始沉淀时c(OH-)=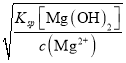 =
=![]() mol/L=10-6mol/L,此时溶液的pH=8,则除去该溶液中的Al3+,需要调节pH的范围为4.7<pH<8;
mol/L=10-6mol/L,此时溶液的pH=8,则除去该溶液中的Al3+,需要调节pH的范围为4.7<pH<8;
②溶浸过程会发生:CaSO4(s)+CO32-(aq)![]() CaCO3(s)+SO42-(aq),依据硫酸钙、碳酸钙溶度积常数的计算表达式,反应的平衡常数K=
CaCO3(s)+SO42-(aq),依据硫酸钙、碳酸钙溶度积常数的计算表达式,反应的平衡常数K=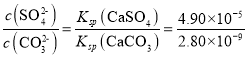 =1.75×104。
=1.75×104。


科目:高中化学 来源: 题型:
【题目】用下列装置进行相应实验,能达到实验目的的是
A.用图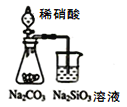 装置可证明非金属性强弱:N>C>Si
装置可证明非金属性强弱:N>C>Si
B.用图 装置可制备少量O2,其优点是能随时控制反应的发生和停止
装置可制备少量O2,其优点是能随时控制反应的发生和停止
C.用图 装置可配制100mL一定物质的量浓度的硫酸溶液
装置可配制100mL一定物质的量浓度的硫酸溶液
D.用图 装置可蒸发 NaCl溶液得到氯化钠晶体
装置可蒸发 NaCl溶液得到氯化钠晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作不能达到实验目的的是
A | B | C | D |
|
|
|
|
分离乙酸乙酯与饱和碳酸钠溶液 | 除去乙炔中的硫化氢 | 检验反应生成的气体中含有乙烯 | 酸性:醋酸>碳酸>硼酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:
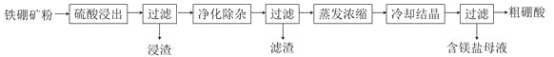
回答下列问题:
(1)写出Mg2B2O5·H2O与硫酸反应的化学方程式_____________。为提高浸出速率,除适当增加硫酸浓度浓度外,还可采取的措施有_________(写出两条)。
(2)利用______的磁性,可将其从“浸渣”中分离。“浸渣”中还剩余的物质是______(写化学式)。
(3)“净化除杂”需先加H2O2溶液,作用是_______。然后再调节溶液的pH约为5,目的是________。
(4)“粗硼酸”中的主要杂质是___________________________(填名称)。
(5)以硼酸为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,其电子式为_______。
(6)单质硼可用于生成具有优良抗冲击性能硼钢。以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y是合成香料、医药、农药及染料的重要中间体,可由X在一定条件下合成:

下列说法不正确的是
A. Y的分子式为C10H8O3
B. 由X制取Y的过程中可得到乙醇
C. 一定条件下,Y能发生加聚反应和缩聚反应
D. 等物质的量的X、Y分别与NaOH溶液反应,最多消耗NaOH的物质的量之比为3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制250 mL、0.10 mol·L-1的NaOH溶液时,下列实验操作会使配得的溶液中NaOH物质的量浓度偏大的是( )
A.转移溶液后未洗涤烧杯和玻璃棒就直接定容
B.准确称量1.0 g NaOH进行配制
C.在容量瓶中进行定容时俯视刻度线
D.定容后把容量瓶倒置摇匀,发现液面低于刻度线,又补足了所缺的水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(一)①己知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ/mol,CO(g)+H2O(g)=CO2(g)+H2(g)△H=+2.8 kJ/mol,
2CO(g)+O2(g)=2CO2(g)△H=-566.0 kJ/mol,
反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)的△H=_____。
2CO(g)+2H2(g)的△H=_____。
②250℃时,以镍合金为催化剂,向2L容器中通入6mol CO2、6mol CH4,发生如下反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。2min后达到平衡,测得平衡体系中H2的体积分数为40%。此温度下该反应的平衡常数K=______。2min内CO2平均消耗速率为________。
2CO(g)+2H2(g)。2min后达到平衡,测得平衡体系中H2的体积分数为40%。此温度下该反应的平衡常数K=______。2min内CO2平均消耗速率为________。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如下图所示。250~300℃时,乙酸的生成速率减小的原因是_________。
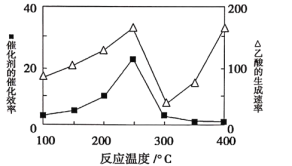
②为了提高该反应中CH4的转化率,可能采取的措施是__________________。
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为_____________________。
(3)第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供动力,降低油耗;在刹车或下坡时,电池处于充电状态。混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH溶液)为电解质溶液。镍氢电池充放电原理示意图如下,其总反应式为H2+2NiOOH![]() Ni(OH)2。
Ni(OH)2。
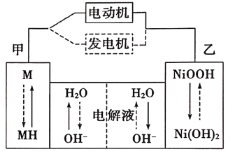
根据所给信息判断,混合动力车上坡或加速时,该电池处于________(选填“充电”或“放电”),乙电极的电极反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g)![]() Z(g),经60s达到平衡,生成0.3molZ,下列说法正确的是( )
Z(g),经60s达到平衡,生成0.3molZ,下列说法正确的是( )
A.将容器体积变为20L,Z的平衡浓度变为原来的一半
B.若增大压强,则物质Y的转化率减小
C.若升高温度,X的体积分数增大,则该反应的△H>0
D.以X浓度变化表示的反应速率为0.001mol/(L·s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com