
【题目】已知X+Y![]() M+N反应中的能量变化过程如图,则下列有关说法正确的是
M+N反应中的能量变化过程如图,则下列有关说法正确的是
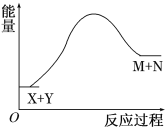
A. X的能量一定低于M的能量,Y的能量一定低于N的能量
B. 破坏反应物中的化学键所吸收的能量大于形成生成物中化学键所放出的能量
C. 因为该反应为吸热反应,故一定要加热反应才能进行
D. 加入催化剂,可减小M+N与X+Y间的能量差
【答案】B
【解析】
A.反应热取决于反应物与生成物的总能量,而不是某一种反应物或生成物的能量关系;
B.反应物的总能量低于生成物的总能量时反应是吸热反应;
C.吸热反应不一定在加热的条件下发生;
D.催化剂能降低反应的活化能,不改变反应热。
A.由图可知,反应物的总能量低于生成物的总能量,不能说明X的能量一定低于M的能量,Y的能量一定低于N的能量,选项A错误;
B、由图可知,反应物的总能量低于生成物的总能量,X+Y![]() M+N是一个吸热反应,则破坏反应物中的化学键所吸收的能量大于形成生成物中化学键所放出的能量,选项B正确;
M+N是一个吸热反应,则破坏反应物中的化学键所吸收的能量大于形成生成物中化学键所放出的能量,选项B正确;
C、吸热反应不一定在加热的条件下发生,比如氯化铵和Ba(OH)2·8H2O的反应是吸热反应,但常温下就能发生,选项C错误;
D、催化剂能降低反应的活化能,不改变反应热,加入催化剂,M+N与X+Y间的能量差不变,选项D错误;
答案选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
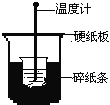
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________。
(2)烧杯间填满碎纸条的作用是_____________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值将_______(填“偏大”、“偏小”或“无影响”)。
(4)实验中改用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比较,所放出的热量________(填“相等”或“不相等”),但中和热应_________(填“相等”或“不相等”),简述理由_________________________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值与57.3kJ/mol相比较会__________;用50mL0.50mol/LNaOH溶液进行上述实验,测得中和热的数值与57.3kJ/mol相比较会__________(均填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在373K时,把0.5molN2O4气体通入体积为5L(恒容)的真空密闭容器中,立即出现红棕色。反应进行到60s时体系达到平衡,此时容器内压强为反应前的1.6倍。下列说法不正确的是
A. 平衡时,N2O4的转化率为60%
B. 平衡时,体系内NO2为0.04mol·L-1
C. 其它条件不变,平衡后再往该密闭容器中通入0.5molN2O4气体,重新达到平衡时N2O4的体积百分数增大
D. 其它条件不变,平衡后再往该密闭容器中通入1molN2O4气体,重新达到平衡时该反应平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有相同官能团的有机物化学性质相似。下列5个有机物中,能够发生酯化、加成和氧化3种反应的是
①CH2=CHCOOH ②CH2=CHCOOCH3 ③CH2=CHCH2OH
④CH3CH2CH2OH ⑤![]()
A. ①③⑤B. ②④⑤
C. ①③④D. ①②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化学反应的平衡常数表达式为![]() ,在不同的温度下该反应的平衡常数如下表:
,在不同的温度下该反应的平衡常数如下表:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
下列有关叙述不正确的是( )
A. 若在1 L的密闭容器中通入CO2和H2各1 mol,5 min后温度升高到830 ℃,此时测得CO2为0.4 mol时,该反应达到平衡状态
B. 上述反应的正反应是放热反应
C. 该反应的化学方程式是CO(g)+H2O(g) ![]() CO2(g)+H2 (g)
CO2(g)+H2 (g)
D. 若平衡浓度符合下列关系式:![]() ,则此时的温度为1000 ℃
,则此时的温度为1000 ℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由废铁制备FeCl2并测定FeCl2的含量。主要过程如下所示:

I.按上图所示过程制备FeCl3·6H2O。
(1)用离子方程式表示过程②中稀硝酸的作用:_________________________。
(2)在过程②中要不断向溶液中补充盐酸,目的是___________________。
(3)步骤③的操作是_______________________ 。
Ⅱ.由FeCl3·6H2O制得干燥FeCl2的过程如下所示:
①向盛有FeCl3·6H2O的容器中加入SOCl2,加热,获得无水FeCl3;
②将无水FeCl3置于反应管中,通入过程①中产生的气体一段时间后加热,生成FeCl2;
③收集FeCl2,保存备用。
(4)上述过程2中产生FeCl2的化学方程式是________________________。
Ⅲ.测定FeCl2的含量。
分析方法:①取a g样品配制成100 mL溶液;②用移液管吸取所配溶液5.00 mL,放入500 mL、锥形瓶内并加水200 mL;③加硫酸锰溶液20.00mL,用0.1 mol/L酸性高锰酸钾标准溶液滴定,终点时消耗酸性高锰酸钾标准溶液V mL。
(5)滴定终点的判断依据是______________________。
(6)滴定时如果不加入硫酸锰很容易导致测定结果偏高,则加入硫酸锰可使测定结果准确的原因可能是_____________________ 。
(7)若所配溶液中![]() (FeC12) (g/L) =kV(式中V——消耗的酸性高锰酸钾标准溶液的毫升数),则k=_____________(保留四位有效数字)。
(FeC12) (g/L) =kV(式中V——消耗的酸性高锰酸钾标准溶液的毫升数),则k=_____________(保留四位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3 mol A和2.5 mol B混合于2 L密闭容器中,发生的反应如下:3A(g)+B(g) ![]() xC(g)+2D(g),5 min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1 mol/(L·min),下列结论正确的是
xC(g)+2D(g),5 min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1 mol/(L·min),下列结论正确的是
A. A的平均反应速率为 0.1 mol/(L·min)
B. 平衡时,C的浓度为 0.125 mol/L
C. 平衡时,B的转化率为 20%
D. 平衡时,容器内压强为原来的 0.8 倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物的结构简式为![]() ,判断下列说法中不正确的是
,判断下列说法中不正确的是
A. 它可以使酸性KMnO4溶液褪色
B. 它可发生取代反应、加成反应、加聚反应、氧化反应
C. 它与氢气发生加成反应,最多可以消耗5mol氢气
D. 1mol该有机物燃烧消耗氧气为18.5mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com