
【题目】Ⅰ.中和滴定
(1)用酸式滴定管量取20.00 mL待测稀盐酸溶液放入锥形瓶中,并滴加1~2滴酚酞作指示剂,用0.20 mol·L-1NaOH标准溶液进行滴定。为了减小实验误差,该同学一共进行了三次实验,假设每次所取稀盐酸体积均为20.00 mL,三次实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗NaOH溶液体积/mL | 19.00 | 23.00 | 23.02 |
该盐酸的浓度约为_____________(保留两位有效数字)。滴定达到终点的标志是_____________。
(2)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______。
A. 滴定终点读数时俯视读数
B. 酸式滴定管使用前,水洗后未用待测盐酸润洗
C. 锥形瓶水洗后未干燥
D. 配制NaOH标准溶液时,没有等溶解液降至室温就转移至容量瓶中
E. 配制NaOH标准溶液时,定容时仰视容量瓶的刻度线
F. 碱式滴定管尖嘴部分有气泡,滴定后消失
Ⅱ.(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________
A. KMnO4 B. H2O2 C. 氯水 D. HNO3
(2)然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的_______。
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(3)常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为_______,Fe3+完全沉淀时溶液的pH为________(已知 lg5 = 0.7 )
【答案】0.23 mol·L-1 滴入最后一滴NaOH溶液加入,溶液由无色恰好变成浅红色且半分钟内不褪色 EF B CD 4 3.3
【解析】
Ⅰ.(1)酸遇酚酞不变色,碱遇酚酞变红,利用c(碱)= 来进行计算浓度;(2)根据c(待测)=
来进行计算浓度;(2)根据c(待测)=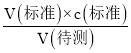 分析不当操作对V(标准)的影响,以此判断浓度的误差;
分析不当操作对V(标准)的影响,以此判断浓度的误差;
Ⅱ.(1)加入合适氧化剂,使Fe2+氧化为Fe3+,不能引入新的杂质;
(2)调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,则加含铜元素的物质与氢离子反应促进铁离子水解转化为沉淀;
(3)依据氢氧化铜饱和溶液中溶度积常数计算溶液中的氢离子浓度,然后计算pH;结合氢氧化铁溶度积和残留在溶液中的离子浓度小于1×10-5 molL-1时就认为沉淀完全。
Ⅰ.(1)利用酸式滴定管量取20.00mL待测稀盐酸溶液放入锥形瓶中,因酸遇酚酞不变色,碱遇酚酞变红,则滴定终点的标志为最后一滴NaOH溶液加入,溶液由无色恰好变成浅红色,半分钟内不褪色;由c(碱)= 可知,因第一次数据差别较大,则V(NaOH)=
可知,因第一次数据差别较大,则V(NaOH)=![]() =23.01mL,则c(HCl)=
=23.01mL,则c(HCl)=![]() ≈0.23 mol·L-1;
≈0.23 mol·L-1;
(2)A.滴定终点读数时俯视读数,读取的标准液的体积偏小,由c(待测)=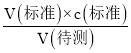 可知测定结果偏低,故A错误;
可知测定结果偏低,故A错误;
B.酸式滴定管水洗后未用待测稀盐酸溶液润洗,盐酸的浓度偏小,所取盐酸溶液的溶质的物质的量偏小,造成V(标准)偏小,根据c(待测)=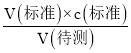 分析,可知测定浓度偏小,故B错误;
分析,可知测定浓度偏小,故B错误;
C.锥形瓶水洗后未干燥,不影响滴定时标准液的体积,根据c(待测)=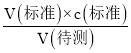 分析,可知测定浓度无影响,故C错误;
分析,可知测定浓度无影响,故C错误;
D.配制NaOH标准溶液时,没有等溶解液降至室温就转移至容量瓶中,配制的标准液浓度偏大,滴定时消耗标准液的体积偏小,由c(待测)=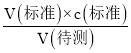 可知测定结果偏低,故D错误;
可知测定结果偏低,故D错误;
E.配制NaOH标准溶液时,定容时仰视容量瓶的刻度线,容量瓶内溶液的体积偏大,导致标准NaOH溶液的浓度偏低,滴定时消耗标准液的体积偏大,由c(待测)=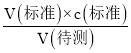 可知测定结果偏高,故E正确;
可知测定结果偏高,故E正确;
F.碱式滴定管尖嘴部分有气泡,滴定后消失,读取的标准NaOH溶液的体积偏大,由c(待测)=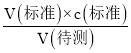 可知测定结果偏高,故F正确;
可知测定结果偏高,故F正确;
故答案为EF;
Ⅱ.(1)加入合适氧化剂,使Fe2+氧化为Fe3+,不能引入新的杂质,A、C、D都会引入杂质,只有过氧化氢的还原产物为水,不引入杂质,故答案为B;
(2)调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,则加含铜元素的物质与氢离子反应促进铁离子水解转化为沉淀,同时不引入新的杂质, NaOH或NH3·H2O会引入Na+或NH4+,而CuO和Cu(OH)2在调节溶液pH的同时不影响溶液的成份,故答案为CD;
(3)Cu(OH)2的溶度积Ksp=3.0×10-20,溶液中CuSO4的浓度为3.0molL-1,c(Cu2+)=3.0molL-1;依据溶度积常数c(Cu2+)×c2(OH-)=3.0×10-20;c2(OH-)=![]() =10-20;得到c(OH-)=10-10mol/L,依据水溶液中的离子积c(H+)×c(OHspan>-)=10-14;可知c(H+)=10-4mol/L,此时溶液pH=4,则Cu(OH)2开始沉淀时溶液的pH为4;残留在溶液中的离子浓度小于1×10-5 molL-1时就认为沉淀完全,Fe(OH)3的溶度积Ksp=8.0×10-38,c(Fe3+)×c3(OH-)=8.0×10-38;c3(OH-)=
=10-20;得到c(OH-)=10-10mol/L,依据水溶液中的离子积c(H+)×c(OHspan>-)=10-14;可知c(H+)=10-4mol/L,此时溶液pH=4,则Cu(OH)2开始沉淀时溶液的pH为4;残留在溶液中的离子浓度小于1×10-5 molL-1时就认为沉淀完全,Fe(OH)3的溶度积Ksp=8.0×10-38,c(Fe3+)×c3(OH-)=8.0×10-38;c3(OH-)=![]() =8.0×10-33;求的c(OH-)=2×10-11mol/L;水溶液中的离子积c(H+)×c(OH-)=10-14;c(H+)=5×10-4mol/L,则pH=3.3。
=8.0×10-33;求的c(OH-)=2×10-11mol/L;水溶液中的离子积c(H+)×c(OH-)=10-14;c(H+)=5×10-4mol/L,则pH=3.3。


科目:高中化学 来源: 题型:
【题目】SDIC是一种性能稳定的高效广谱杀菌消毒剂,广泛用于环境水处理食品加工公共场所等清洁消毒,结构如图甲所示其中WXYRZ均为短周期元素且原子序数依次增大,Z在同周期主族元素中原子半径最小,且Z与Y位于不同周期
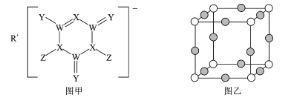
回答下列问题:
(1)SDIC中,电负性最小的元素是____(填元素名称) ,其中W最外层的孤电子对数为__________。
(2)基态X3-的核外电子排布式为____某离子晶体中含有X3-和M+两种离子,其中M+核外电子正好充满KLM3个能层,则M的元素符号是___ ,该晶体晶胞结构如图乙所示,则X3-的配位数为____
(3)X≡X的键能为942kJ/mol,X-X单键的键能为247kJ/mol,则X的最常见单质中____(填“σ”或“π”)键更稳定
(4)X的最简单氢化物是___ 分子(填“极性”或“非极性”),该分子与1个H+结合形成离子时键角___ (填“变大”“变小”或“不变”),原因是____
(5)SDIC的原子发射光谱中呈现特征颜色的微观原因是____
(6)在由R和Y的单核离子组成的晶体中,阴离子的排列方式为面心立方最密堆积,阳离子填充在全部的正四面体空隙中已知晶胞参数为anm,阿伏加德罗常数的值为NA,则该晶体密度为____g/cm3 (列出计算式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示的是纯净物、单质、化合物、含氧化合物、氧化物、碱之间的包含、不包含关系,若整个大圆圈代表纯净物,则下列选项中,能正确指出①、②、③、④、⑤所属物质类别的是( )
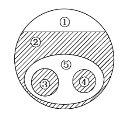
A. ①单质、③化合物
B. ②碱、⑤氧化物
C. ④碱、⑤含氧化合物
D. ④含氧化合物、③氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗硅提纯常见方法之一是先将粗硅与HCl反应制得SiHCl3,经提纯后再用H2还原:SiHCl3(g)+H2(g) ![]() Si(s)+3HCl(g)。在2L密闭容器中,不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图。下列判断合理的是
Si(s)+3HCl(g)。在2L密闭容器中,不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图。下列判断合理的是
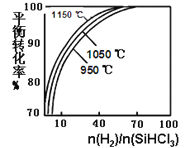
A. X是H2
B. 1150℃反应的平衡常数大于950℃时反应的平衡常数
C. 减小Si(s)的量,有利于提高SiHCl3的转化率
D. 工业上可采用增大压强的方法提高产率
查看答案和解析>>
科目:高中化学 来源: 题型:
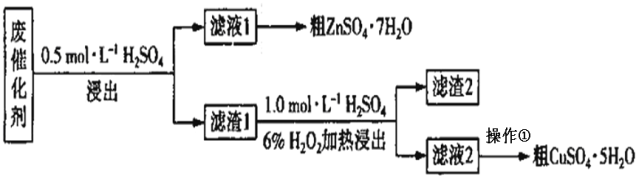
【题目】某废催化剂含SiO2、ZnO、ZnS和CuS。实验室从该废催化剂中回收锌和铜的一种流程如下图所示。
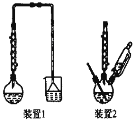
浸出使用的装置如图所示。回答下列问题:
 蒸发浓缩、冷却结晶蒸发浓缩、冷却结晶
蒸发浓缩、冷却结晶蒸发浓缩、冷却结晶
(1)第一次浸出必须选用装置 _______(填“1”或“2”),原因是 ________。滤渣1的主要成分有_______。
(2)第二次浸出时生成单质硫,写出反应的离子方程式:_______________。该步骤即使加热温度不高也可能会有副反应发生,产物之一是空气的主要成分,分析可能原因是_____________________ 。
(3)从滤液2中得到CuSO4·5H2O的操作是 __________ 、过滤、洗涤。
(4)下列叙述中涉及到与该流程中的“操作①”相同操作的是_____________ 。
A.《肘后备急方》中治疟疾:“青蒿一握,以水升渍,绞取汁,尽服之”
B.《本草衍义》中精制砒霜:“将生砒就置火上,以器覆之,令砒烟上飞着覆器”
C.《开宝本草》中获取硝酸钾:“冬月地上有霜,扫取以水淋汁后,乃煎炼而成”
D. 《本草纲目》中烧酒的制造工艺:“凡酸坏之酒,皆可蒸烧”
(5)若该废催化剂中含12.8%的CuS,实验中称取15.0g废催化剂最终得到3.0gCuSO4·5H2O,则铜的回收率为 __________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是国民经济发展的重要材料,铝在地壳中的含量约占8%,目前我国铝消费量超过430万吨,在众多的金属中仅次于铁。请回答下问题:
(Ⅰ)实验室中用金属铝制备少量氢氧化铝,有以下3种方案:
方案1:Al![]() Al3+
Al3+![]() Al(OH)3↓
Al(OH)3↓
方案2:Al![]() AlO
AlO![]()
![]() Al(OH)3↓
Al(OH)3↓
方案3: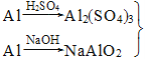 ―→Al(OH)3
―→Al(OH)3
制备相同物质的量的氢氧化铝消耗酸和碱最少的是方案________。
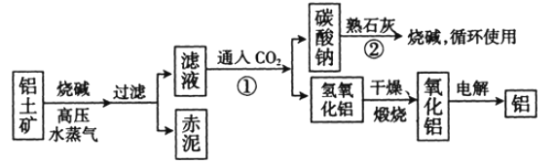
(Ⅱ)工业上冶炼铝的流程图如图所示:
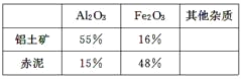
在制取氧化铝的过程中,分析铝土矿和赤泥中所含Al2O3、Fe2O3质量分数的数据如下:
(1)书写化学方程式,反应①________,反应②________。
(2)电解氧化铝生产铝时,阳极的电极反应式为_______________________________________。
(3)假设其他杂质不参加反应,则每生产3.4 t纯净的氧化铝,需铝土矿________t。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同主族元素所形成的同一类型的化合物,往往其结构和性质相似。化合物![]() 是一种晶体,下列对它的叙述中,错误的是
是一种晶体,下列对它的叙述中,错误的是
A.它是一种离子化合物
B.这种化合物水溶液显中性
C.这种化合物加热能分解
D.这种化合物能与氢氧化钠溶液发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莫沙朵林是一种镇痛药,它的合成路线如下:
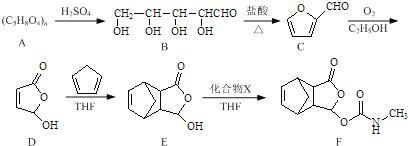
(1)B中手性碳原子数为____________;化合物D中含氧官能团的名称为____________。
(2)C与新制氢氧化铜反应的化学方程式为____________。
(3)写出同时满足下列条件的E的一种同分异构体的结构简式:____________
I.核磁共振氢谱有4个峰;
Ⅱ.能发生银镜反应和水解反应;
Ⅲ.能与FeCl3溶液发生显色反应.
(4)已知E+X→F为加成反应,化合物X的结构简式为____________。
(5)已知:![]() .化合物
.化合物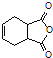 是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以
是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以![]() 和
和![]() 为原料合成该化合物(用合成路线流程图表示,并注明反应条件).______________。
为原料合成该化合物(用合成路线流程图表示,并注明反应条件).______________。
合成路线流程图示例如下:![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的化学资源宝库,利用海水可以提取很多物质。
利用1:提溴工业
用海水晒盐之后的盐卤可提取溴,提取流程如图:
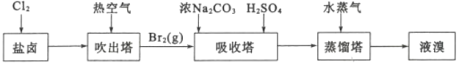
(1)吹出塔中热空气能将溴单质吹出的原因是_____。蒸馏塔中通入水蒸气进行加热,需要控制温度在90℃左右的原因是______。
利用2:提镁工业
从海水提取食盐和Br2之后的盐卤中除含有Mg2+、C1-外,还含有少量Na+、Fe2+、Fe3+、SO42-和CO(NH2)2等,还可以用来提取MgCl2、MgO、Mg(OH)2等物质,流程如图所示:
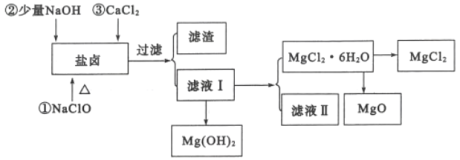
(2)用NaC1O除去尿素CO(NH2)2时,生成物除盐外,还有能参与大气循环的无毒物质,则该反应的化学方程式为_______;加入NaC1O的另一个作用是________。
利用3:淡化工业
(3)海水淡化的方法主要有闪蒸法、离子交换法、电渗析法等。离子交换法淡化海水模拟过程如图所示。氢型阳离子交换原理可表示为:HR+Na+=NaR+H+;……。羟型阴离子交换树脂填充部分存在的反应有:ROH+C1-=RC1+OH-;______;________。
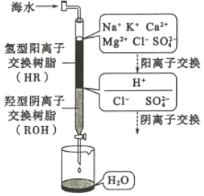
(4)电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示:
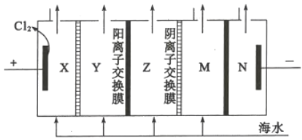
①图中的海水没有直接通入到阴极室中,其原因是_________。
②淡化水在________室(填X、Y、Z、M或N)形成后流出。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com