
����Ŀ����Ҫ��д�Ȼ�ѧ����ʽ��
��1��25�桢101kPa�����³��ȼ��һ������C2H2����ų�����Ϊ1300kJ�����ⶨ�������ɵ�CO2ͨ����������ʯ��ˮ�в���100g��ɫ������д����ʾC2H2������ȼ�յ��Ȼ�ѧ����ʽ��___��
��2����֪ϡ��Һ�У�1molH2SO4��NaOH��Һǡ����ȫ��Ӧʱ���ų�114.6kJ������д����ʾH2SO4��NaOH��Ӧ���к��ȵ��Ȼ�ѧ����ʽ��___��
���𰸡�C2H2(g)+![]() O2(g)=2CO2(g)+H2O(l) ��H=-2600kJ/mol NaOH(aq)+
O2(g)=2CO2(g)+H2O(l) ��H=-2600kJ/mol NaOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() Na2SO4(aq)+H2O(l) ��H=-57.3kJ/mol
Na2SO4(aq)+H2O(l) ��H=-57.3kJ/mol
��������
(1)��������̼��Ƶ�������C2H2�����ʵ��������ȼ���ȵĸ�����д��ʾC2H2ȼ���Ȼ�ѧ����ʽ��
(2)�����к��ȵĸ��ϡ��ǿ���ǿ�Ӧ����1molˮ���ų�����������к��Ȳ���д���к��ȵ��Ȼ�ѧ����ʽ��
(1)n(CaCO3)=![]() =1mol�������CԪ���غ㣬��֪n(CO2)=1mol����C2H2ȼ�����ɵĶ�����̼Ϊ1mol����C2H2ȼ�յĻ�ѧ����ʽ2C2H2+5O2=4CO2+2H2O��֪��Ӧ��C2H2�����ʵ�����n(C2H2)=
=1mol�������CԪ���غ㣬��֪n(CO2)=1mol����C2H2ȼ�����ɵĶ�����̼Ϊ1mol����C2H2ȼ�յĻ�ѧ����ʽ2C2H2+5O2=4CO2+2H2O��֪��Ӧ��C2H2�����ʵ�����n(C2H2)=![]() ����Ϊȼ��
����Ϊȼ��![]() mol��C2H2�ų�������Ϊ1300kJ������ȼ��1molC2H2����CO2����Ͳ���Һ̬ˮ�ų�������2600kJ����C2H2��ȼ����Ϊ2600kJ�����Ա�ʾC2H2ȼ���Ȼ�ѧ����ʽΪC2H2(g)+
mol��C2H2�ų�������Ϊ1300kJ������ȼ��1molC2H2����CO2����Ͳ���Һ̬ˮ�ų�������2600kJ����C2H2��ȼ����Ϊ2600kJ�����Ա�ʾC2H2ȼ���Ȼ�ѧ����ʽΪC2H2(g)+![]() O2(g)=2CO2(g)+H2O(l) ��H=-2600kJ/mol���ʴ�Ϊ��C2H2(g)+
O2(g)=2CO2(g)+H2O(l) ��H=-2600kJ/mol���ʴ�Ϊ��C2H2(g)+![]() O2(g)=2CO2(g)+H2O(l) ��H=-2600kJ/mol��
O2(g)=2CO2(g)+H2O(l) ��H=-2600kJ/mol��
(2)1mol H2SO4��Һ������NaOH��Һ��ȫ��Ӧ���ų�114.6kJ��������������2molˮ�ų�114.6kJ����������Ӧ�ķ�Ӧ��Ϊ-114.6kJ/mol���к���Ϊ-57.3kJ/mol�����к��ȵ��Ȼ�ѧ����ʽNaOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() Na2SO4(aq)+H2O(l) ��H=-57.3kJ/mol���ʴ�Ϊ��NaOH(aq)+
Na2SO4(aq)+H2O(l) ��H=-57.3kJ/mol���ʴ�Ϊ��NaOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() Na2SO4(aq)+H2O(l) ��H=-57.3kJ/mol��
Na2SO4(aq)+H2O(l) ��H=-57.3kJ/mol��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в��ֶ�����Ԫ�ص����ʻ�ԭ�ӽṹ���±���
Ԫ�ر�� | Ԫ�����ʻ�ԭ�ӽṹ |
T | M���ϵ�������K���ϵ�������3�� |
X | �����������Ǵ�����������2�� |
Y | �����µ���Ϊ˫ԭ�ӷ��ӣ����⻯��ˮ��Һ�ʼ��� |
Z | Ԫ����������ǣ�7�� |
��1��Ԫ��Xλ��Ԫ�����ڱ��ĵ�____���ڵ�__�壬����һ�ֺ��ؿɲⶨ������������ֺ��صķ�����____��
��2��Ԫ��Y��ԭ�ӽṹʾ��ͼΪ___������Ԫ���γ�һ������YH4+��д��ij��Һ�к��и����ļ��鷽��_____��
��3��Ԫ��Z��Ԫ��T��ȣ��ǽ����Խ�ǿ����___(��Ԫ�ط��ű�ʾ)�����б�������֤����һ��ʵ����___��
a��������Z�ĵ��ʺ�T�ĵ���״̬��ͬ
b��Z���⻯���T���⻯���ȶ�
c��һ��������Z��T�ĵ��ʶ���������������Һ��Ӧ
��4��̽Ѱ���ʵ����ʲ�������ѧϰ����Ҫ����֮һ��T��X��Y��Z����Ԫ�ص�����������Ӧ��ˮ�����л�ѧ�������Բ�ͬ���������ֵ���____������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ����Ҫ�Ļ���ԭ�ϣ����������Ʊ�������(Si3N4)��(N2H4)��������(HCN)��
(1)��֪��Si(s)+2Cl2(g)====SiCl4(g) ��H1=akJ��mol��1
N2(g)+3H2(g) ![]() 2NH3(g) ��H2=bkJ��mol��1
2NH3(g) ��H2=bkJ��mol��1
3Si(s)+2N2(g)====Si3N4(s) ��H3=ckJ��mol��1
H2(g)+Cl2(g)====2HCl(g) ��H4=dkJ��mol��1
��Ӧ3SiCl4(g)+4NH3(g)====Si3N4(s)+12HCl(g)�ġ�H=________________kJ��mol��1(��a��b��c��d��ʾ)��
(2)�µ��Ʊ��������ô����������������İ���
��֪ClO��ˮ��ķ���ʽΪ��ClO��+H2 O=HClO+OH���������£���ˮ�ⷴӦ��ƽ�ⳣ��ΪK=1.0��10��6mol��L��1����1.0mol�� L ��1NaCIO��Һ��pH=________��
(3)��ҵ�����ð�������������(HCN)�ķ�ӦΪ��CH4(g)+NH3(g) ![]() HCN(g)+3H2 (g) ��H>O
HCN(g)+3H2 (g) ��H>O
����������һ�����ﵽƽ��ʱNH3ת�������������X�仯�Ĺ�ϵ��ͼ��ʾ��X��������________(�����¶�������ѹǿ��)��

����������һ������2L�ܱ������м��� n mol CH4��2 mol NH3��ƽ��ʱNH3���������n�仯�Ĺ�ϵ��ͼ��ʾ������Ӧ�ӿ�ʼ��a������ʱ��Ϊ10min����ʱ�������CH4��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ________mol��L��1��min��1��ƽ�ⳣ����K(a) ________K(b)(����>����=������<��)
�۹�ҵ���õ�ⷨ���������Ʒ�ˮ(pH=10)��װ����ͼ��ʾ��

���������������������Һ��Ӧ����ClO-��ClO����CN�����������ӷ���ʽΪ��_____CN��+ _____ClO��+ ________====_____CO32��+_____N2��+________+________������2 mol CN����������������������(��״����)Ϊ________L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���һ��շ�ˮ�б��ӵĹ�����ͼ��ʾ�����з����������
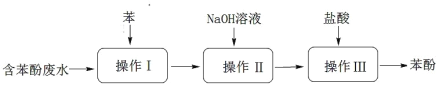
A.������Ϊ��ȡ����Һ����ȡ��Ҳ������ѡ�� CCl4
B.�����������ӻ�����ڱ��е��ܽ�ȱ���ˮ�е�С
C.ͨ��������������ѭ��ʹ�ã�������������Ҫ��Һ©��
D.����մ��Ƥ���ϣ����� NaOH ��Һ��ϴ�����ô���ˮ���ϳ�ϴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ԭ��Ӧ��2Ag++Cu=Cu2++2Ag����Ƶ�ԭ�����ͼ��ʾ��
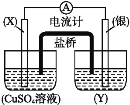
��ش��������⣺
��1���缫X�IJ�����___���缫X��ԭ��ص�___����
��2�����缫�����ĵ缫��ӦΪ___��
��3������2H2+O2![]() 2H2O��Ӧ����ȼ�ϵ�أ�������ͨ��Ӧ��___�������ĵ缫��ӦʽΪ___��
2H2O��Ӧ����ȼ�ϵ�أ�������ͨ��Ӧ��___�������ĵ缫��ӦʽΪ___��
�鿴�𰸺ͽ���>>
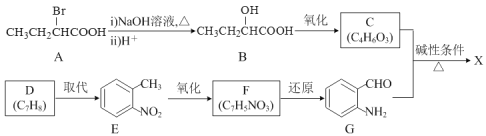
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���X( ![]() )����Ҫ�Ļ����Լ���һ�ֺϳ�·�����£�
)����Ҫ�Ļ����Լ���һ�ֺϳ�·�����£�
��֪����RNH2+ ![]()
![]()
![]() +H2O
+H2O
�� ![]() +H2O
+H2O
(1)D��E�ķ�Ӧ�Լ���������_____��
(2)F�Ľṹ��ʽΪ_____��
(3)һ�������£�HCHO��![]() �Ե����ʵ���������Ӧ���������ɵ������л�����Ľṹ��ʽ��___��
�Ե����ʵ���������Ӧ���������ɵ������л�����Ľṹ��ʽ��___��
(4)�л���X��һ��ͬ���칹��ͬʱ��������������д����ͬ���칹��Ľṹ��ʽ��__��
�ٳ���������������״�ṹ��
���ܷ���������Ӧ�������ᷴӦ�����Σ�
�ۺ˴Ź�������ͼ����4���塣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������İ���ͭ����![]() ������ɱ�����ýȾ�����ڼ��Զ�ͭ��Ҳ���������Һ����Ҫ�ɷ֣��ڹ�ҵ����;�㷺�������¸���������ˮ���������Ҵ������ѣ��ڿ����в��ȶ�������ʱ�����ֽ⡣ij��ѧ��ȤС����Cu�ۡ�3mol/L�����ᡢŨ��ˮ��10% NaOH��Һ��95%���Ҵ���Һ��0.500 mol/Lϡ���ᡢ0.500 mol/L��NaOH��Һ���ϳ������İ���ͭ���岢�ⶨ�䴿�ȡ�
������ɱ�����ýȾ�����ڼ��Զ�ͭ��Ҳ���������Һ����Ҫ�ɷ֣��ڹ�ҵ����;�㷺�������¸���������ˮ���������Ҵ������ѣ��ڿ����в��ȶ�������ʱ�����ֽ⡣ij��ѧ��ȤС����Cu�ۡ�3mol/L�����ᡢŨ��ˮ��10% NaOH��Һ��95%���Ҵ���Һ��0.500 mol/Lϡ���ᡢ0.500 mol/L��NaOH��Һ���ϳ������İ���ͭ���岢�ⶨ�䴿�ȡ�
I��CuSO4��Һ���Ʊ�
�ٳ�ȡ4gͭ�ۣ���A����������10���Ӳ����Ͻ��裬������ȴ��
�����������м���30mL 3mol/L�����ᣬ��A�й��������������У����Ȳ����Ͻ��衣
�۳��ȹ��˵���ɫ��Һ��
(1)A����������Ϊ____��
(2)ijͬѧ��ʵ������1.5g��ͭ��ʣ�࣬��ͬѧ���Ƶõ�CuSO4��Һ������һ�������м���Ũ�����о�Ĥ���֣���ȴ�����ľ����к��а�ɫ��ĩ���Խ�����ԭ��_____
II��������Ʊ�
�������Ʊ���CuSO4��Һ����ͼ��ʾ���в���
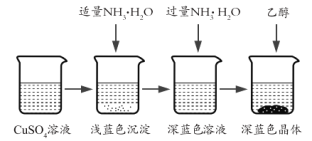
(3)��֪dz��ɫ�����ijɷ�Ϊ![]() ����д�����ɴ˳��������ӷ�Ӧ����ʽ_________��
����д�����ɴ˳��������ӷ�Ӧ����ʽ_________��
(4)��������ʱ���ü����Ҵ��ķ�����������Ũ���ᾧ��ԭ����__��
III���������IJⶨ
��ȷ��ȡmg���壬������ˮ�ܽ⣬ע����ͼ��ʾ������ƿ�У�Ȼ����μ���VmL10%NaOH��Һ��ͨ��ˮ����������ƷҺ�еİ�ȫ����������������ˮ��ϴ�����ڱڣ���V1mL C1mol/L���������Һ��ȫ���ա�ȡ�½���ƿ����C2mol/L NaOH����Һ�ζ���ʣ��HCl(ѡ�ü�����ָʾ��)�����յ�ʱ����V2mLNaOH��Һ��
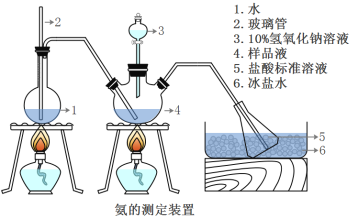
(5)Aװ���г������ܵ�����_____����Ʒ�а������������ı���ʽ_______��
(6)����ʵ���������ʹ�������ⶨ���ƫ�͵�ԭ����_______��
A���ζ�ʱδ��NaOH����Һ��ϴ�ζ���
B������ʱ���ζ�ǰƽ�ӣ��ζ�����
C���ζ�������ѡ�÷�̪��ָʾ��
D��ȡ�½���ƿǰ��δ������ˮ��ϴ�������ƿ�еĵ�����ڡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ��װ�û������ʵ��Ŀ�����������
|
|
|
|
A. ֤��ͭ������ķ�Ӧ | B. �����Ҵ�������Ļ��Һ | C. ֤������������ˮ��ˮ��Һ�ʼ��� | D. ����100 mL0.100 mol/LNaCl��Һ |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС��ͨ������ʵ��̽�� KI ��FeCl3��Һ�ķ�Ӧ��ʵ����̺��������� ��
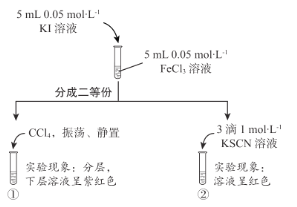
����˵������ȷ����
A.�Թܢ�������֤����I2����
B.�Թܢ�������֤����Һ�д���Fe3+
C.KI ��FeCl3��Һ�ķ�Ӧ����ʽΪ��2Fe3++ 2I-=2Fe2+ + I2
D.�ۺϸ�ʵ�����֪��Fe3+��I2������������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com