

| 滴定次数实验数据 | 1 | 2 | 3 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 |
| V(KMnO4)/mL(初读数) | 0.00 | 0.20 | 0.00 |
| V(KMnO4)/mL(终读数) | 15.85 | 15.22 | 14.98 |

分析 (1)CO32-水解生成OH-,溶液显碱性,酯在碱性条件下完全水解;
(2)由于硫酸亚铁的溶解度随温度的升高二增大;
(3)①转移液体需要引流;
②硝酸有强氧化性,盐酸有还原性;高锰酸钾有强氧化性,应放在酸式滴定管中;滴定终点时,颜色变成紫红色,并且半分钟内不褪色;配平反应的离子方程式:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O,滴定中由于第一组数据误差较大,应舍去,以此计算;
(4)氢氧化亚铁易被氧化为氢氧化铁;反应生成的气体将硫酸亚铁压入B中,反应生成氢氧化亚铁白色沉淀.
解答 解:(1)CO32-水解生成OH-,溶液显碱性,酯在碱性条件下完全水解,所以可用纯碱溶液除油污,故答案为:除去废铁屑表面的油污;
(2)由于硫酸亚铁的溶解度随温度的升高二增大,因此用冰水洗涤的另一个目的是减少洗涤过程中FeSO4•7H2O的损耗,故答案为:降低FeSO4在水中的溶解度,减少FeSO4•7H2O的损耗;
(3)①转移液体需要引流,玻璃棒底部要在容量瓶的刻度线以下且玻璃棒不能碰到容量瓶口,
故答案为:用玻璃棒引流,玻璃棒底部要在容量瓶的刻度线以下且玻璃棒不能碰到容量瓶口;
②硝酸有强氧化性,盐酸有还原性,能被高能酸钾氧化为氯气,只能用稀硫酸;
高锰酸钾有强氧化性,能氧化橡皮管,应放在酸式滴定管中;
滴定终点时,颜色变成紫红色,并且半分钟内不褪色,否则不可以判断达到终点;
配平反应的离子方程式:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O,滴定中由于第一组数据误差较大,应舍去,
反应需要的高锰酸钾的物质的量为$\frac{15.02+14.98}{2}$×10-3L×1.2×10-2mol/L=18×10-5mol
则:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
5mol 1mol
n 18×10-5mol
n=18×10-5mol×5=90×10-5mol,
则1.500g硫酸亚铁补血剂药片含铁的质量为90×10-5mol×56g/mol=0.0504g,所以该补血剂中铁元素的含量为$\frac{0.0504}{1.5}$×100%=3.36%,
故答案为:c;酸式;滴入最后一滴KMnO4溶液,恰好变为紫红色,且半分钟内不退色;3.36%;
(4)氢氧化亚铁易被氧化为氢氧化铁,应先排除装置中的空气;反应生成的气体将硫酸亚铁压入B中,反应生成氢氧化亚铁白色沉淀;离子方程式是Fe2++2OH-=Fe(OH)2↓,故答案为:排除装置中的空气,防止氢氧化亚铁被氧化为氢氧化铁;液面上升出现白色沉淀 Fe2++2OH-=Fe(OH)2↓.
点评 本题考查了铁及其化合物性质的分析判断和反应产物的计算判断,元素守恒、元素化合价是解题关键,题目难度中等.


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三氯化铁可用作净水剂,是因为氢氧化铁胶体具有吸附性 | |
| B. | 氢氧化铁胶粒直径在10-9一10-7m之间 | |
| C. | 氯化铁溶液转变成氢氧化铁胶体是化学变化,氢氧化铁胶体变成氢氧化铁沉淀是物理变化 | |
| D. | 氢氧化铁胶体的分散质是氢氧化铁分子,分散剂是水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.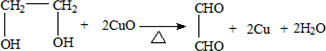 .
. .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  放出碘的苯溶液 | B. |  分离碘并回收苯 | ||
| C. |  将海带灼烧成灰 | D. |  过滤的含I-溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯 | B. | 乙醇 | C. | 乙酸 | D. | 苯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com