
V、W、X、Y、Z是五种常见元素,其中V、W、X、Y四种短周期元素在周期表中的位置如下图所示:V、W的最简单气态氢化物M、N混合时有白烟生成,M能使湿润的pH试纸变蓝。Z是人体血红蛋白中存在的金属元素。请填写下列空白:
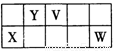
(1)W的原子结构示意图为 ;
(2)二氧化钛(TiO2)与X的单质、Y的单质高温下反应生成两种化合物,这两种化合物均由两种元素组成。其反应的化学方程式为 ;
(3)含X元素的一种化合物A与Y的最高价氧化物C之间有如下的反应关系:
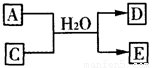
若E为白色沉淀,则E物质的化学式为 ;
(4)常温下,相同浓度 X、Z简单离子的溶液中滴加NaOH溶液,X、Z两元素先后沉淀,X(OH)n完全沉淀的pH是4.7,Z(OH)n完全沉淀的pH是2.8,则Ksp[X(OH)n] (填“>”或 “<”) Ksp[Z(OH)n];
(5)Y与氢能形成多种化合物,其中一种为Y2H2。2.00g Y2H2完全燃烧生成液态水和二氧化碳,放出99.6kJ热量,写出Y2H2燃烧的热化学反应方程式________________________________________________________;
(6)同温同压下,将a L M气体和b LN气体通入水中,若所得溶液的pH=7,则a b(填“>"或“<”或“=”)。
(15分)(1) 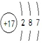 (2分)
(2分)
(2)4Al + 3 TiO2 +3C 2 Al2O3 +3TiC
(3分)
2 Al2O3 +3TiC
(3分)
(3)Al(OH)3 (2分)
(4)>(2分)
(5)2C2H2 (g)+5O2(g) ==4CO2(g)+2H2O(l) △H=-2589.6kJ/mol (3分)
(6) >(3分)
【解析】
试题分析:(1)由题意可知,V、W、X、Y分别为氮、氯、铝、碳,M、N分别是氨气和氯化氢,Z是铁,氯原子核电荷数为+17,核外电子层结构为287;(2)铝由0价升为+3价,碳由0价将为—4价,由电子、原子守恒配平,该氧化还原反应方程式为4Al+3TiO2+3C 2Al2O3 +3TiC;(3)碳酸的酸性比氢氧化铝强,由题意可知,该反应式为NaAlO2+CO2+2H2O==Al(OH)3↓+NaHCO3;(4)由题意可知,优先生成溶解度较小的沉淀,则Ksp[X(OH)n]>Ksp[Z(OH)n];(5)由m/M可知,n(C2H2)=1/13mol,由题意可知,1/13C2H2(g)+5/26O2(g)==2/13CO2(g)+1/13H2O(l)
△H=—99.6kJ•mol—1,或2C2H2 (g)+5O2(g) ==4CO2(g)+2H2O(l)
△H=-2589.6kJ/mol;(6)若a=b,则NH3与HCl恰好反应生成NH4Cl,NH4Cl中NH4+水解导致所得溶液呈酸性,要使所得溶液的pH=7,则氨气一定过量,得到氨水和氯化铵的混合溶液,则a>b。
2Al2O3 +3TiC;(3)碳酸的酸性比氢氧化铝强,由题意可知,该反应式为NaAlO2+CO2+2H2O==Al(OH)3↓+NaHCO3;(4)由题意可知,优先生成溶解度较小的沉淀,则Ksp[X(OH)n]>Ksp[Z(OH)n];(5)由m/M可知,n(C2H2)=1/13mol,由题意可知,1/13C2H2(g)+5/26O2(g)==2/13CO2(g)+1/13H2O(l)
△H=—99.6kJ•mol—1,或2C2H2 (g)+5O2(g) ==4CO2(g)+2H2O(l)
△H=-2589.6kJ/mol;(6)若a=b,则NH3与HCl恰好反应生成NH4Cl,NH4Cl中NH4+水解导致所得溶液呈酸性,要使所得溶液的pH=7,则氨气一定过量,得到氨水和氯化铵的混合溶液,则a>b。
考点:考查物质结构和元素周期律、氧化还原反应、铝及其化合物的性质、溶度积与沉淀的生成、热化学方程式、酸碱混合溶液的酸碱性等相关知识。


科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:


| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com