
【题目】配位化合物的数量巨大,组成和结构形形色色,丰富多彩。请指出配合物 [Cu(H2O)4](OH)2的中心离子、配体、中心离子的电荷数和配位数
A.Cu2+、H2O、+2、4 B.Cu+、H2O、+1、4
C.Cu2+、OH-、+2、2 D.Cu2+、H2O、+2、2
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
【题目】【2015江苏卷】己烷雌酚的一种合成路线如下:

下列叙述正确的是( )
A.在NaOH水溶液中加热,化合物X可发生消去反应
B.在一定条件,化合物Y可与HCHO发生缩聚反应
C.用FeCl3溶液可鉴别化合物X和Y
D.化合物Y中不含有手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(l)基态As原子的核外电子排布式为[Ar]______,有________个未成对电子。
(2) As与N是同主族元素,从原子结构角度分析:为什么As的最高价含氧酸H3AsO4是三元酸(含三个轻基),而N的最高价含氧酸HNO3是一元酸(只含一个烃基)______。
(3)比较下列氢化物的熔点和沸点,分析其变化规律及原因__________。
(4) Na3AsO3中Na、As、O电负性由大至小的顺序是______。AsO33-的空间构型为___, AsO33-中As的杂化轨道类型为_______杂化。
(5)砷化稼(GaAs)为黑灰色固体,熔点为1238℃。该晶体属于___晶体,微粒之间存在的作用力是_________。
NH3 | PH3 | AsH3 | SbH3 | |
熔点/K | 195.3 | 140.5 | 156.1 | 185 |
沸点/K | 239.6 | 185.6 | 210.5 | 254.6 |
(6)图为GaAs的晶胞,原子半径相对大小是符合事实的,则白球代表____原子。
己知GaAs的密度为5.307g·cm3, Ga和As的相对原子质量分别为69.72、74.92,求晶胞参数a=______pm (列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸越稀还原产物中氮元素的化合价越低。某同学取铁铝合金与足量很稀的硝酸充分反应没有气体放出。在反应后的溶液中逐渐加入4mol·L-1NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图所示(不考虑沉淀的微量溶解)。下列说法不正确的是
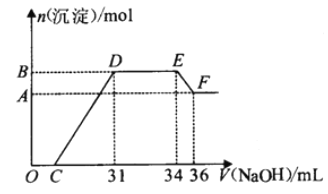
A. D点溶液中存在:c(NH4+)+c(Na+)+c(H+)=c(OH-)+c(NO3-)
B. EF段发生反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O
C. D点溶液中n(NH4+)=0.012mol
D. 由水电离产生的c(H+):O点>F点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图将锌片和铜片用导线连接后放入稀硫酸溶液中,发生原电池反应,下列叙述错误的是

A.溶液的pH增大 B.溶液中的Zn2+浓度增大
C.溶液中的SO42-浓度增大 D.溶液的密度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年全国各地雾霾严重,为有效控制雾霾,各地积极采取措施改善大气质量。研究并有效控制空气中氮氧化物、碳氧化物等污染物是一项重要而艰巨的工作。
Ⅰ.氮氧化物的研究
(1)一定条件下,将2mol NO与2mol O2置于恒容密闭容器中发生反应:2NO(g)+O2(g) ![]() 2NO2(g),下列状态能说明该反应达到化学平衡的是(_______)
2NO2(g),下列状态能说明该反应达到化学平衡的是(_______)
A.混合气体的密度保持不变
B.NO的转化率保持不变
C.NO和O2的物质的量之比保持不变
D.O2的消耗速率和NO2的消耗速率相等
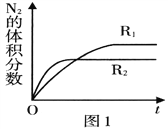
(2)已知反应. 2NO(g) ![]() N2(g)+O2(g) ΔH<O,在不同条件时N2的体积分数随时间(t)的变化如图1所示。根据图象可以判断曲线R1、R2对应的下列反应条件中不同的是______ (填字母序号)。
N2(g)+O2(g) ΔH<O,在不同条件时N2的体积分数随时间(t)的变化如图1所示。根据图象可以判断曲线R1、R2对应的下列反应条件中不同的是______ (填字母序号)。
A.压强 B.温度 C.催化剂
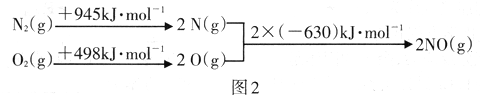
根据图2中的能量变化数据.计算反应2NO(g) ![]() N2(g)+O2(g)的ΔH=__________
N2(g)+O2(g)的ΔH=__________
Ⅱ.碳氧化物研究
(3)CO和H2在一定条件下可以合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) ΔH<O ,现在体积为1L的恒容密闭容器(图3甲)中通入1mol CO和2mol H2,测定不同时间、不同温度(T)下容器中CO的物质的量,如下表:
CH3OH(g) ΔH<O ,现在体积为1L的恒容密闭容器(图3甲)中通入1mol CO和2mol H2,测定不同时间、不同温度(T)下容器中CO的物质的量,如下表:

请回答:
①T1_____ T2(填“>”或“<”或“=”),理由是____________________。已知T2℃时,第20min时容器内压强不再改变,此时H2的转化率为_________,该温度下的化学平衡常数为________ 。
②若将1mol CO和2mol H2通入原体积为1L的恒压密闭容器(图3乙)中,在T2℃下达到平衡,此时反应的平衡常数为_________;若再向容器中通入l mol CH3OH(g),重新达到平衡后,CH3OH(g)在体系中的百分含量_________(填“变大”或“变小”或“不变”)。
(4)一定条件下也可用NaOH溶液与CO反应生成甲酸钠,进一步反应生成甲酸来消除CO污染。常温下将a mol的CO通入2 L bmol/L NaOH 溶液中,恰好完全反应生成甲酸钠和含少量甲酸的混合溶液(假设溶液体积不变),测得溶液中c(Na+)=c(HCOO-),则该混合溶液中甲酸的电离平衡常数 Ka=____________ (用含a和b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于钠元素的单质及其化合物的叙述错误的是( )
A.钠是银白色金属,氧化钠是白色粉末,过氧化钠是淡黄色粉末
B.大量的钠着火时可以用沙扑灭,不能用水或泡沫灭火剂灭火
C.金属钠在空气中长期放置,最终变为碳酸钠。
D.Na2O和Na2O2都能由金属钠和氧气化合生成,Na2O和Na2O2氧的价态也相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。

下列说法正确的是( )
A. 沸点A2D<A2X
B. CA3分子是非极性分子
C. C形成的单质中σ键与π键个数之比为1∶2
D. B、C、D形成的气态氢化物互为等电子体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到目的的是( )
A. 氯化铁溶液中滴加稀氨水制备氢氧化铁胶体
B. 将NH4Cl溶液蒸干制备NH4Cl固体
C. 用萃取分液的方法除去酒精中的水
D. 用可见光束照射以区别溶液和胶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com