
分析 (1)6.72LNO2的物质的量为0.3mol,设Cu为xmol,Zn为ymol,根据质量9.65g与生成NO2的物质的量0.3mol列式计算;
(2)铁粉部分溶解,说明生成Fe(NO3)2,却无气体产生说明即生成NH4NO3;
(3)由加入NaOH没有刺激性气体产生,得到没有生成NH3,则得到的无色气体为NO、N2,根据原子守恒和得失电子守恒计算物质的量.
解答 解:(1)标准状况下,6.72LNO2的物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,设Cu为xmol,Zn为ymol,则
①xmol×64g/mol+ymol×65g/mol=9.65g
②2xmol+2ymol=0.3mol,
①②联立解得:x=0.1,y=0.05,
因此该合金中铜与锌的物质的量之比为0.1mol:0.05mol=2:1,
故答案为:2:1;
(2)铁粉部分溶解,说明生成Fe(NO3)2,却无气体产生说明即生成NH4NO3,所以方程式为10HNO3+4Fe=4Fe(NO3)2+NH4NO3+3H2O,
再加NaOH,Fe(NO3)2都转化成Fe(OH)2,并进一步转化成Fe(OH)3,再灼烧,则生成Fe2O3为4.8g,Fe2O3的物质的量为$\frac{4.8g}{160g/mol}$=.03mol,
所以Fe为0.03mol×2=0.06mol,HNO3为0.06mol×$\frac{10}{4}$=0.15mol,因此该硝酸溶液的物质的量浓度为$\frac{0.15mol}{0.1L}$=1.5mol/L,
答:反应的化学方程式为10HNO3+4Fe=4Fe(NO3)2+NH4NO3+3H2O;硝酸溶液的物质的量浓度为1.5mol/L;
(3)13g锌的物质的量为$\frac{13g}{65g/mol}$=0.2mol,2.464L气体共$\frac{2.464L}{22.4L/mol}$=0.11mol,HNO3的物质的量为0.2L×3.6mol/L=0.72mol,测得反应后的溶液pH=0,则剩余H+的物质的量为1mol/L×0.2L=0.2mol,因此有0.72mol-0.2mol=0.52mol硝酸发生了反应,
由加入NaOH没有刺激性气体产生,得到没有生成NH3,NO2为红棕色气体,因此得到的无色气体为NO、N2;
化学方程式为20Zn+52HNO3=20Zn(NO3)2+26H2O+10NO(g)+N2(g),
因此无色气体为NO 0.1mol和N2 0.01mol,
答:无色气体有NO和N2组成,NO 0.1mol,N2 0.01mol.
点评 本题考查了化学方程式的计算,侧重于化学性质、原子守恒、电荷守恒的应用,题目难度较大,熟悉物质的性质及物质之间的转化是解题的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一小块钾投入冷水中:K+2H2O═K++2OH-+H2↑ | |
| B. | 氯气通入碘化钠溶液中:2I-+Cl2═I2+2Cl- | |
| C. | 稀硫酸滴在铁片上:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 氯气通入氯化亚铁溶液中:Fe2++Cl2═Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
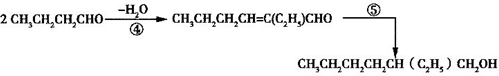
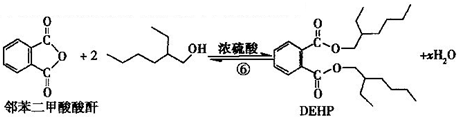
| A. | 合成过程涉及加成、消去、酯化、聚合等类型的有机反应 | |
| B. | 步骤(1)中②反应发生的条件是在NaOH/醇溶液中加热,反应类型是消去反应 | |
| C. | 步骤(1)(2)连续操作时,③、⑤消耗H2物质的量相等 | |
| D. | ⑥反应方程式中产物H2O系数x=2,及时除去⑥中反应釜内的水可提高DEHP产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 事实 | 非金属 | |
| A | 第I电离能 M<N | M>N |
| B | 电负性M=N | M=N |
| C | 基态原子价层电子排布 M:nsnnpn+3,N:nsnnpn+4 | M>n |
| D | 原子半径 M>N | M<N |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
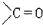 +RMgX→
+RMgX→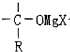
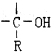

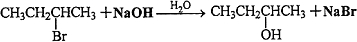 ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com