
【题目】Ⅰ、重金属离子对河流及海洋造成严重污染。某化工厂废水(pH=2.0,ρ≈1g·mL-1)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01mol·L-1。排放前拟用沉淀法除去这两种离子,查找有关数据如下:
难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
(1)你认为往废水中投入_____(填字母序号),沉淀效果最好。
A.NaOH B.Na2S C.KI D.Ca(OH)2
(2)常温下,如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=___。
(3)如果用食盐处理其只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%。若环境要求排放标准为c(Ag+)低于1.0×10-8mol·L-1,问该工厂处理后的废水中c(Ag+)=__,是否符合排放标准__(填“是”或“否”)。已知Ksp(AgCl)=1.8×10-10mol2·L-2。
Ⅱ、为了研究难溶盐的沉淀溶解平衡和沉淀转化,某同学设计如下实验。
步骤1:向2mL0.005 mol/LAgNO3溶液中加入2 mL0.005 mol/LKSCN溶液,静置。 | 出现白色沉淀。 |
步骤2:取1 mL上层清液于试管中,滴加1滴2 mol/LFe(NO3)3溶液。 | 溶液变为红色。 |
步骤3:向步骤2的溶液中,继续加入5滴3mol/LAgNO3溶液。 | 现象a,且溶液红色变浅。 |
步骤4:向步骤1余下的浊液中加入5滴3mol/LKI溶液。 | 出现黄色沉淀。 |
已知:25℃,Ksp(AgI,黄色)=8.3×1017 ,Ksp(AgSCN,白色)= 1.0×1012 。
回答下列问题:
(4)步骤3中现象a是_______。
(5)向50mL0.005 mol/L的AgNO3溶液中加入150mL0.005 mol/L的KSCN溶液,若混合后溶液体积为200mL,则溶液中Ag+的浓度约为____
【答案】B 1.2×10-3mol·L-1 9×10-9mol·L-1 是 出现白色沉淀 4.0×1010
【解析】
(1)溶度积越小越易转化为沉淀,根据表格中的数据进行判断;
(2)先计算出溶液中氢氧根离子的物质的量浓度,然后根据Pb(OH)2的溶度积及c(Pb2+)=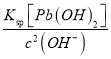 进行计算;
进行计算;
(3)根据氯化银的溶度积进行解答,并与排放标准对比来说明是否符合排放标准;
(4)银离子会和硫氰酸根离子之间反应得到AgSCN白色沉淀;
(5)向50mL 0.005molL1的AgNO3溶液中加入150mL0.005molL1的 KSCN溶液,KSCN过量,根据溶液中剩余的KSCN的浓度,结合Ksp (AgSCN )计算。
(1)溶度积越小的越易转化为沉淀,由表格中的数据可知,硫化物的溶度积更小,所以应选择硫化钠,故答案为:B。
(2)由Pb(OH)2的溶度积为1.2×10-15,pH=8.0,c(OH-)=10-6molL-1,则c(Pb2+)=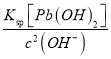 =
=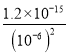 =1.2×10-3molL-1;
=1.2×10-3molL-1;
(3)废水中NaCl的质量分数为0.117%,ρ≈1gmL-1,c(Cl-)=c(NaCl)=1000mL×1gmL-1×0.117%/58.5gmol-1=0.02mol/L;Ksp(AgCl)=c(Ag+)c(Cl-)=1.8×10-10mol2L-2,所以c((Ag+)=![]() =9×10-9mol/L<1.0×10-8molL-1, 环境要求排放标准为c(Ag+)低于1.0×10-8molL-1,所以符合排放标准;
=9×10-9mol/L<1.0×10-8molL-1, 环境要求排放标准为c(Ag+)低于1.0×10-8molL-1,所以符合排放标准;
(4)加入硝酸银,银离子会和硫氰酸根离子之间反应得到AgSCN白色沉淀;
(5)向50mL 0.005molL-1的AgNO3溶液中加入150mL0.005molL-1的 KSCN溶液,KSCN过量,溶液中剩余的c(SCN-)=![]() =0.0025mol/L,则c(Ag+)=
=0.0025mol/L,则c(Ag+)=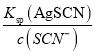 =
=![]() molL1=4×10-10molL-10。
molL1=4×10-10molL-10。


科目:高中化学 来源: 题型:
【题目】假设烷烃的通式为![]() ,以下物理量随n的增加而减小的是 ( )
,以下物理量随n的增加而减小的是 ( )
A. 1mol烷烃中共价键的数目B. 1mol烷烃完全燃烧时的耗氧量
C. 一氯代物的种类D. 氢元素的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定苏打中Na2CO3的含量(含NaHCO3杂质),实验小组设计了如下三个实验方案。
方案Ⅰ.①称量:仪器X的质量为ag;②称量:仪器X和装有试样的质量为bg;③加热;④冷却;⑤称量:仪器X和残余物的质量为cg;⑥重复____________操作,直至恒重,质量为dg。
(1)仪器X是____________(填名称),方案 Ⅰ 的实验原理是:____________(用化学方程式表示)。
(2)请将步骤⑥补充完整:重复____________操作,步骤⑥的目的是:____________。
(3)计算Na2CO3的质量分数要用到的数据是____________(选填a、b、c、d)。
方案Ⅱ.称量一定量样品,选用合适的装置测定样品与硫酸反应生成的气体体积。
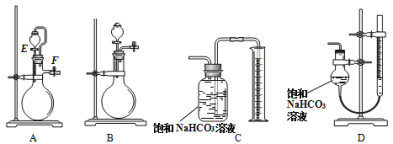
(4)为提高测定准确性,应选用发生装置____________(选填“A”或“B”)和量气装置D;装置D比装置C准确性高的原因是____________(任一条原因)。
(5)检查装置A的气密性:向A的分液漏斗中加入适量水,按图连接好装置,关闭止水夹F,打开活塞E,发现分液漏斗中的水持续滴下,说明A漏气。该判断是否正确,并说明理由:____________。
方案Ⅲ.称量0.2570g样品,置于锥形瓶中,加适量水溶解,滴2滴酚酞试液,用0.1000mol/L盐酸滴定至溶液由浅红色变成无色且半分钟不变色,反应原理:Na2CO3+HCl→NaHCO3+NaCl,重复上述操作两次。
(6)用密度为1.19g/mL、质量分数为0.37的浓盐酸,配制1L0.1000mol/L稀盐酸,所需的定量仪器是:滴定管、1L容量瓶,其中滴定管的作用是____________。滴定管和容量瓶在使用前都要进行的操作是__________。(选填序号)
Y.检漏 Z.用蒸馏水洗涤 W.用待装液润洗
(7)根据表中数据,碳酸钠的质量分数为____________(小数点后保留四位)。
滴定次数 | 样品的质量/g | 稀盐酸的体积/mL | |
滴定前读数 | 滴定后读数 | ||
1 | 0.2570 | 1.00 | 21.01 |
2 | 0.2570 | 0.50 | 20.49 |
3 | 0.2570 | 1.20 | 21.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,我国科学家研制出以石墨烯为载体的催化剂,在25℃下用H2O2直接将CH4转化为含氧有机物,其主要原理如图所示:

下列说法不正确的是( )
A.图中![]() 代表H2O2
代表H2O2
B.步骤i、ii的总反应方程式是![]()
C.由上图可知,步骤iv生成的H2O,其中的H原子全部来自H2O2
D.根据以上原理,推测步骤vi生成HCOOH和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其它杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如图流程:

已知:某些金属阳离子可以通过“控制pH”[即调节溶液的酸碱性,pH=-lgc(H+), pH值越大,碱性越强]使其转化为沉淀。固体2为白色沉淀。
(1)加足量酸之后的实验操作是______________________。
(2)溶解烧渣选用的足量酸能否是盐酸,并说明理由___________________________。
(3)验证溶液2中是否含有Fe3+的方法:_______________________________________。
(4)试剂X的作用是_________________。
(5)从溶液2中得到绿矾的操作步骤为:______________、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有________________。(此空填序号)
A.蒸发皿 B.石棉网 C.烧杯 D.玻璃棒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4与Cl2生成CH3Cl的反应过程,中间态物质的能量关系见下图。有关说法错误的是
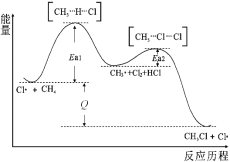
A.Cl·是由Cl2在光照下化学键断裂生成的,该过程可表示为:![]()
B.反应过程一定无CH3CH3的生成
C.图中的反应热Q>0,其大小与Ea1、Ea2无关
D.CH4转化为CH3Cl的过程,C-H键发生了断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.把5.1g镁铝合金的粉末放入足量的氢氧化钠溶液中,得到2.24LH2(标准状况下测定)。
(1)合金中镁的质量为________。
(2)写出该合金溶于足量的氢氧化钠溶液的化学方程式:_________________________。
Ⅱ. 在AlCl3和MgCl2的混合溶液中逐滴加入氢氧化钠溶液,生成沉淀的物质的量与加入氢氧化钠的物质的量的关系如图所示。
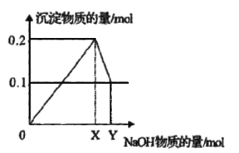
(3)在混合溶液中AlCl3和MgCl2的物质的量之比为_____________。
(4)写出XY段发生反应的离子方程式_____________________________。
(5)X=____________;Y=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.3 g纯净的金属钠在干燥的空气中缓慢加热,被氧化后得到3.5 g固体,由此可判断出产物是( )
A.氧化钠B.过氧化钠
C.氧化钠和过氧化钠的混合物D.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com