
【题目】已知海水提取镁的主要步骤如下:
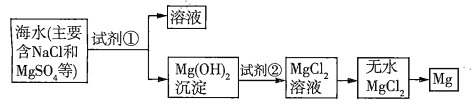
(1)关于加入试剂①作沉淀剂,有以下方法,请完成下列问题。
方法 | 是否合理 | 简述理由 |
方法:高温加热蒸发海水后,再加入沉淀剂 | a | b |
你认为合理的其他方法是c |
a. _____________;
b.____________;
c.____________。
(2)框图中加入的试剂①应该是_______(填物质名称),加入试剂②的溶质是_______(填化学式)。工业上由无水![]() 制取镁的化学方程式为___________。
制取镁的化学方程式为___________。
【答案】不合理 能源消耗大,不经济 向海滩晒盐后得到的苦卤中加入沉淀剂 石灰乳 ![]()

【解析】
(1)高温加热蒸发海水后,再加入沉淀剂,能源消耗大,不经济,可采用向海滩晒盐后得到的苦卤中加入沉淀剂;
(2)试剂①作沉淀剂,生成氢氧化镁沉淀,加入试剂②生成氯化镁,工业制镁采用电解熔融的氯化镁制取,以此分析。
(1)高温加热蒸发海水后,再加入沉淀剂,能源消耗大,不经济,可采用向海滩晒盐后得到的苦卤中加入沉淀剂,
故答案为:不合理;能源消耗大,不经济;向海滩晒盐后得到的苦卤中加入沉淀剂;
(2)试剂①应是石灰乳,发生的反应是![]() ;试剂②应是盐酸,发生的反应是
;试剂②应是盐酸,发生的反应是![]() ,然后经过浓缩、结晶、脱水得无水
,然后经过浓缩、结晶、脱水得无水![]() ,电解再电解熔融的
,电解再电解熔融的![]() 便可制得
便可制得![]() :
: ,
,
故答案为:石灰乳;![]() ;
; 。
。


科目:高中化学 来源: 题型:
【题目】可逆反应 A(g)+3B(g)![]() 2C(g)+2D(g),在不同情况下,测得有下列四个反应速率,其反应速率最快的是( )
2C(g)+2D(g),在不同情况下,测得有下列四个反应速率,其反应速率最快的是( )
A. v(A)=0.15molL﹣1s﹣1B. v(B)=0.6molL﹣1s﹣1
C. v(C)=0.5molL﹣1s﹣1D. v(D)=0.4molL﹣1s﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种测定水样中溴离子的浓度的实验步骤如下:
①向锥形瓶中加入处理后的水样25.00mL,加入几滴NH4Fe(SO4)2溶液。
②加入V1mL c1mol·L-1 AgNO3溶液(过量),充分摇匀。
③用c2mol·L-1KSCN标准溶液进行滴定,至终点时消耗标准溶液V2mL 。
(已知:Ksp(AgBr)=7.7×10-13,Ag++SCN-= AgSCN(白色)↓,Ksp(AgSCN)=1×10-12)下列说法不正确的是
A. 滴定终点时,溶液变为红色
B. 该滴定法需在碱性条件下进行
C. AgBr(s)+SCN-![]() AgSCN(s)+Br-(aq)的平衡常数K=0.77
AgSCN(s)+Br-(aq)的平衡常数K=0.77
D. 该水样中溴离子浓度为:c(Br-)=(c1V1-c2V2)/25.00mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图所示装置检验乙烯时不需要除杂的是
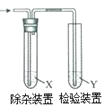
乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是探究铁发生腐蚀的装置图。发现开始时U形管左端红墨水水柱下降,一段时间后U形管左端红墨水水柱又上升。下列说法中不正确的是( )
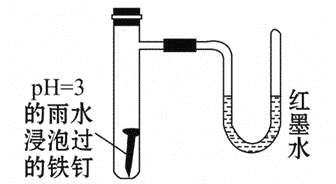
A.开始时发生的是析氢腐蚀
B.一段时间后发生的是吸氧腐蚀
C.两种腐蚀负极的电极反应式均为Fe-2e-=Fe2+
D.析氢腐蚀的总反应式为2Fe+O2+2H2O=2Fe(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的叙述中正确的是( )
A.能够使甲基橙变黄的溶液一定为碱性溶液
B.以KI溶液为标准溶液滴定未知浓度的FeCl3溶液,可选用淀粉溶液作为指示剂
C.使用量程为50mL的滴定管测量溶液体积时,开始时读数为21.00mL,将滴定管中剩余液体全部放出,则所得溶液体积大于29.00mL
D.盛待测液的滴定管,第一次读数,平视凹液面最低处,第二次仰视,则所测待测液浓度偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca = CaCl2+Li2SO4+Pb。下列有关说法正确的是

A. 正极反应式:Ca + 2Cl--2e- = CaCl2
B. 放电过程中,Li+向负极移动
C. 没转移0.1mol电子,理论上生成20.7 g Pb
D. 常温时,在正负极间接上电流表或检流计,指针不偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用如图所示实验装置则可制得纯净的Fe(OH)2沉淀, 两极材料分别为石墨和铁。

①a电极材料为_______,该电极的电极反应式为________.
②若白色沉淀在电极周围生成,则电解液d是____(填序号,下同);若白色沉淀在两极之间的溶液中生成,则电解液d是____。
A.纯水 B.NaCl溶液 C.NaOH溶液D.CuCl2溶液
③液体c为苯,其作用是__________
④要想尽早在两极之间的溶液中看到白色沉淀, 可以采取的措施是(_______)
A.改用稀硫酸作电解 B.适当增大电源电压 C.适当降低电解液温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为工业合成氨的流程图。有关说法错误的是

A. 步骤①中“净化”可以防止催化剂中毒
B. 步骤②中“加压”既可以提高原料的转化率,又可以加快反应速率
C. 步骤③、④、⑤均有利于提高原料的转化率
D. 产品液氨除可生产化肥外,还可用作制冷剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com