
【题目】甲~庚等元素在周期表中的相对位置如表,己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数,下列判断正确的是( )
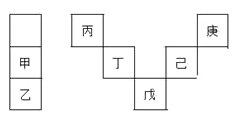
A.丙与戊的原子序数相差28
B.气态氢化物的稳定性:庚<己<戊
C.常温下,甲和乙的单质均能与水剧烈反应
D.丁的最高价氧化物为分子晶体,可用于制造光导纤维
科目:高中化学 来源: 题型:
【题目】某温度下,向10 mL 0.1 mol/L CuCl2溶液中滴加0.1 mol/L的Na2S溶液,滴加过程中溶液中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法不正确的是
(已知:Ksp(ZnS)=3×10-25mol2/L2)

A.a、b、c三点中,水的电离程度最大的为b点
B.Na2S溶液中:2c(S2-)+2c(HS-)+2c(H2S)=c(Na+)
C.该温度下Ksp(CuS)=10-35.4 mol2/L2
D.向100 mL Zn2+、Cu2+浓度均为10-5 mol/L的混合溶液中逐滴加入10-4 mol/L的Na2S溶液,Cu2+先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酒精检测仪可帮助执法交警测试驾驶员饮酒的多少,其工作原理示意图如下图所示。反应原理为:CH3CH2OH+O2=CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量。下列说法正确的是( )
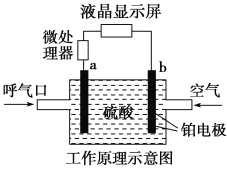
A.电解质溶液中的H+移向a电极
B.b为正极,电极反应式为:O2+4H++4e-=2H2O
C.若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气
D.呼出气体中酒精含量越高,微处理器中通过的电流越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A.2.8g14N2与14C16O的混合物中,中子数目为 l.4NA
B.含 0. l molFeCl3的溶液与0. l mol 锌充分反应,转移电子数为0.l NA
C.标准状况下,5.6gC4H8中 C-C 的数目可能为0.4NA
D.某温度下,1LpH=9 的 Na2CO3 溶液中,水电离产生的OH-数目为10-5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列说法正确的是
A.pH 相等的盐酸和醋酸,加水稀释相同倍数后,c(Cl-)=c(CH3COO- )
B.0.l molL-1 氨水的p H= a,加入适量的氯化铵固体可使溶液pH= a+ l
C.物质的量浓度相等的 (NH4)2SO4 溶液与(NH4) 2CO3溶液中, 前者大于后者
前者大于后者
D.等物质的量浓度等体积的醋酸溶液和氢氟酸溶液,与足量氢氧化钠反应,放出的热量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积均为 1.0L 的恒容密闭容器中发生反应: CH3OH(g)+CO(g) CH3COOH(g) △H<0。下列说法正确的是
容器编号 | 温度/K | 物质的起始浓度/mol/L | 乙酸的平衡浓度/ mol/L | 平衡常数 | ||
c(CH3OH) | c(CH3OH) | c(CH3COOH) | c(CH3COOH) | |||
I | 530 | 0.50 | 0.5 | 0 | 0..40 | K1 |
II | 530 | 0.20 | 0.2 | 0.4 | K2 | |
III | 510 | 0 | 0 | 0.5 | K3 | |
A.三个容器中的平衡常数 K1<K2< K3
B.达平衡时,容器I与容器II中的总压强之比为3 : 4
C.达平衡时,容器I中CH3OH转化率与容器 III 中CH3COOH转化率之和小于l
D.达平衡时,容器III中的正反应速率比容器I中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五氧化二钒(V2O5)为强氧化剂,易被还原成各种低价氧化物,在工业生产中常用作催化剂,即触媒。实验室以含钒废料(含V2O3、CuO、MnO、SiO2、Al2O3、有机物)为原料制备V2O5的一种流程如图:
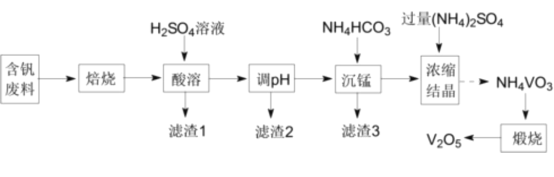
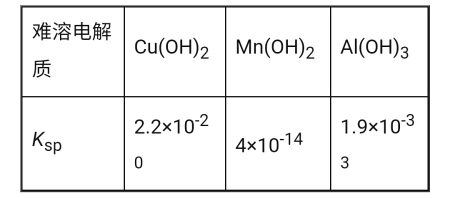
已知I.25℃时,难溶电解质的溶度积常数如表所示:
II.NH4VO3在水中的溶解度:20℃、4.8g·L-1;60℃、24.2g·L-1。
回答下列问题:
(1)“焙烧”的目的是__。
(2)“滤渣1”的用途为__(写出一种即可)。
(3)滤渣2成分为__。通过列式计算说明,常温下,若“调pH”为6,Cu2+是否沉淀完全__。(溶液中离子浓度小于10-5mol·L-1时,认为该离子沉淀完全)
(4)“沉锰”需将温度控制在70°C左右,温度不能过高或过低的原因为___。
(5)滤渣3成分为MnCO3,请写出“沉锰”的离子方程式__。
(6)V2O5最重要的应用是在接触法制硫酸时,作SO2氧化为SO3的催化剂。该催化反应中VO2为中间产物,请用化学方程式表示该催化过程:__、__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为
A.920 kJB.557 kJC.436 kJD.188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子。工业上通过分离液态空气获得X单质。Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和。Z基态原子的最外能层只有一个电子,其他能层均己充满电子。请回答下列问题:
(1) Z2+基态核外电子排布式为______________。
(2) YX4-的空间构型是______________,与YX4-互为等电子体的一种分子为_____________(填化学式);HYX4酸性比HYX2强,其原因是_____________。
(3)结构简式为RX (W2H3)2的化合物中R原子的杂化轨道类型为_____________;lmo1RX (W2H3) 2分子中含有σ键数目为_____________。
(4)往Z的硫酸盐溶液中通入过量的WH3,可生成[Z(WH3)4]SO4,下列说法正确的是_____________。
A. [Z(WH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(WH3)4]2+中Z2+给出孤对电子,NH3提供空轨道
C.在[Z(WH3)4]SO4组成元素中第一电离能最大的是氧元素
(5)某Y与Z形成的化合物的晶胞如图所示(黑点代表Z原子)。
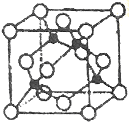
①该晶体的化学式为_____________
②已知Z和Y的电负性分别为1.9和3.0,则Y与L形成的化合物属于_____________(填“离子”、“共价”)化合物。
③已知该晶体的密度为ρg.cm-3,阿伏加德罗常数为NA,则该晶体中Z原子和Y原子之间的最短距离为_____________pm(只写计算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com