
ЁОЬтФПЁПФГЧПЫсадШмвК X жаПЩФмКЌга Ba2+ЁЂA13+ЁЂNH4+ЁЂFe2+ЁЂFe3+ЁЂCO32-ЁЂSO32-ЁЂSO42-ЁЂC1-ЁЂNO2-жаЕФвЛжжЛђМИжжЃЌЯжШЁ X ШмвКНјааСЌајЪЕбщЃЌЪЕбщЙ§ГЬМАВњЮяШчЯТЃК
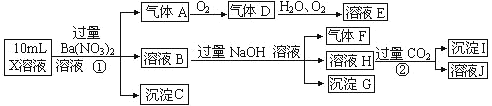
ИљОнвдЩЯаХЯЂЃЌЯТСаХаЖЯе§ШЗЕФЪЧ
A.X ШмвКжавЛЖЈДцдк A13+ЁЂNH4 + ЁЂFe3+ЁЂSO42-
B.X ШмвКжаПЩФмДцдк SO32-ЁЂC1-ЁЂNO2-
C.ЯђШмвК J жаМгШыЙ§СПЕФШмвК EЃЌзюжеШмвКжаПЩФмКЌгаСНжжШмжЪ
D.ГСЕэ I вЛЖЈЪЧ Al (OH)3
ЁОД№АИЁПD
ЁОНтЮіЁП
ЧПЫсадШмвКжавЛЖЈВЛЛсДцдкCO32-КЭSO32-РызгЃЌМгШыЙ§СПЯѕЫсБЕЩњГЩГСЕэЃЌдђИУГСЕэЮЊBaSO4ГСЕэЃЌЫЕУїШмвКжаКЌгаSO42-РызгЃЌЩњГЩЦјЬхAЃЌAСЌајбѕЛЏЩњГЩDКЭEЃЌдђAЮЊNOЃЌDЮЊNO2ЃЌEЮЊHNO3ЃЌЫЕУїШмвКжаКЌгаЛЙдадРызгЃЌвЛЖЈЮЊFe2+РызгЃЌШмвКBжаМгШыЙ§СПNaOHШмвКЃЌЩњГЩЦјЬхFЃЌдђFЮЊNH3ЃЌЫЕУїШмвКжаКЌгаNH4+РызгЃЌШмвКHжаЭЈШыЙ§СПCO2ЦјЬхЃЌЩњГЩГСЕэIЃЌдђIЮЊAl(OH)3ЃЌHЮЊNaAlO2ЃЌЫЕУїШмвКжаКЌгаAl3+РызгЃЌШмвКжаКЌгаFe2+РызгЃЌОЭвЛЖЈВЛКЌNO2-РызгЃЌКЌгаSO42-РызгОЭвЛЖЈВЛКЌBa2+РызгЃЌВЛФмШЗЖЈЪЧЗёКЌгаЕФРызгFe3+КЭCl-ЃЌИљОнЩЯЪіЗжЮіЃЌШмвКжавЛЖЈКЌгаA13+ЁЂNH4+ ЁЂFe2+ЁЂSO42-ЃЛвЛЖЈВЛДцдкBa2+ЁЂCO32-ЁЂSO32-ЁЂNO2-ЃЛПЩФмДцдкFe3+КЭCl-ЃЌЙЪAЁЂBДэЮѓЃЛШмвКHжаКЌгаЧАМИВНМгШыЕФЙ§СПЕФBa2+ЁЂNa+ЁЂOH-ЁЂNO3-КЭЩњГЩЕФ AlO2-ЃЌЭЈШыЙ§СПCO2ЃЌЕУЕНЕФШмвКJжаКЌгаBa2+ЁЂNa+ЁЂNO3-КЭHCO3-ЃЌМгШыЙ§СПЕФЯѕЫс(ШмвКE)ЃЌзюжеШмвКжагаЯѕЫсФЦЁЂЯѕЫсБЕКЭЙ§СПЕФЯѕЫсЃЌЙЪCДэЮѓЃЛГСЕэI ЪЧ Al (OH)3ЃЌЙЪDе§ШЗЃЛЙЪбЁDЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПБъзМзДПіЯТЃЌНЋвЛПщЬњШмгк800mL1mol/LЕФЯЁСђЫсШмвКжаЃЌЗДгІЭъШЋЃЌЧѓЃК
ЃЈ1ЃЉЫљШмНтЬњЕФжЪСПЮЊЖрЩй____ЃП
ЃЈ2ЃЉВњЩњЕФH2ЕФЬхЛ§ЮЊЖрЩй____ЃП
ЃЈ3ЃЉЭъШЋЗДгІКѓЃЌСђЫсбЧЬњЕФХЈЖШЪЧЖрЩй____ЃП
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЪЕбщЪвРћгУСђЫсГЇЩедќ(жївЊГЩЗжЮЊЬњЕФбѕЛЏЮяМАЩйСПFeSЁЂSiO2ЕШ)жЦБИОлЬњ[Fe2(OH)n(SO4)3Ѓ0.5n] mКЭТЬЗЏ(FeSO4ЁЄ7H2O)ЃЌЙ§ГЬШчЯТЃК
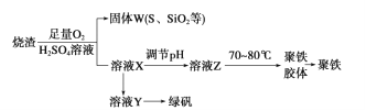
(1)бщжЄЙЬЬхWБКЩеКѓВњЩњЕФЦјЬхКЌгаSO2ЕФЗНЗЈЪЧ________________ЁЃ
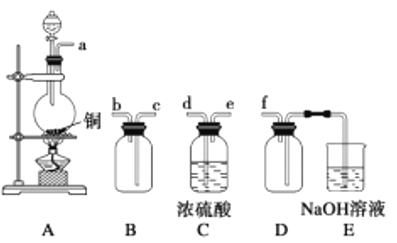
(2)ЪЕбщЪвжЦБИЁЂЪеМЏИЩдяЕФSO2ЃЌЫљашвЧЦїШчЯТЁЃзАжУAВњЩњSO2ЃЌАДЦјСїЗНЯђСЌНгИївЧЦїНгПкЃЌЫГађЮЊaЁњ______Ёњ_____Ёњ______Ёњ______ЁњfЁЃ_________зАжУAжаЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊ___________ЁЃDзАжУЕФзїгУ________ЁЃ
(3)жЦБИТЬЗЏЪБЃЌЯђШмвКXжаМгШыЙ§СП_______ЃЌГфЗжЗДгІКѓЃЌОЙ§ТЫВйзїЕУЕНШмвКYЃЌдйОХЈЫѕЁЂНсОЇЕШВНжшЕУЕНТЬЗЏЁЃЙ§ТЫЫљашЕФВЃСЇвЧЦїга______________ЁЃ
(4)гћВтЖЈШмвКYжаFe2+ЕФХЈЖШЃЌашвЊгУШнСПЦПХфжЦKMnO4БъзМШмвКЃЌгУKMnO4БъзМШмвКЕЮЖЈЪБгІбЁгУ________ЕЮЖЈЙм(ЬюЁАЫсЪНЁБЛђЁАМюЪНЁБ)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаУшЪіжае§ШЗЕФЪЧЃЈ ЃЉ
A.![]() ЮЊVаЮЕФМЋадЗжзг
ЮЊVаЮЕФМЋадЗжзг
B.ClO3-ЕФПеМфЙЙаЭЮЊЦНУцШ§НЧаЮ
C.SF6жага7ЖдЭъШЋЯрЭЌЕФГЩМќЕчзгЖд
D.SiF4КЭSO32-ЕФжааФдзгОљЮЊsp3дгЛЏ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП![]() ФГгаЛњЮяЭъШЋШМЩеЃЌЕУЕН8.8gЖўбѕЛЏЬМКЭ5.4gЫЎЁЃДЫгаЛњЮяЕФеєЦјЖдЧтЦјЕФЯрЖдУмЖШЮЊ23ЃЌИУгаЛњЮягыН№ЪєФЦЗДгІЗХГіЧтЦјЁЃЦфЗжзгЪНЮЊ___________ЃЌНсЙЙМђЪН__________ЁЃ
ФГгаЛњЮяЭъШЋШМЩеЃЌЕУЕН8.8gЖўбѕЛЏЬМКЭ5.4gЫЎЁЃДЫгаЛњЮяЕФеєЦјЖдЧтЦјЕФЯрЖдУмЖШЮЊ23ЃЌИУгаЛњЮягыН№ЪєФЦЗДгІЗХГіЧтЦјЁЃЦфЗжзгЪНЮЊ___________ЃЌНсЙЙМђЪН__________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПИпТШЫсяЇЃЈNH4ClO4ЃЉвзЗжНтВњЩњДѓСПЦјЬхЃЌГЃгУзїЛ№М§ЭЦНјМСЁЃЪЕбщЪвПЩЭЈЙ§ЯТСаЗДгІжЦШЁЃКNaClO4ЃЈaqЃЉ+ NH4Cl ЃЈaqЃЉ![]() NH4ClO4 ЃЈaqЃЉ+NaCl ЃЈaqЃЉЁЃ
NH4ClO4 ЃЈaqЃЉ+NaCl ЃЈaqЃЉЁЃ
ЃЈ1ЃЉШє NH4Cl гУАБЦјКЭХЈбЮЫсДњЬцЃЌЩЯЪіЗДгІВЛашвЊЭтНчЙЉШШОЭФмНјааЃЌЦфдвђЪЧ_____ЁЃ
ЃЈ2ЃЉИљОнШчЭМЕФШмНтЖШЧњЯпЃЌдкЗДгІКѓЕУЕНЕФЛьКЯШмвКжаЛёЕУ NH4ClO4 ОЇЬхЕФЪЕбщВйзївРДЮЮЊЃК_____ЃЌЯДЕгЃЌИЩдяЁЃ
ЃЈ3ЃЉдкЩЯЪіВйзїжаЃЌЯДЕгМСгІбЁдё_____
A. ШШЫЎ B. ввДМ C. БљЫЎ D. ТЫвК
ЃЈ4ЃЉбљЦЗжа NH4ClO4 ЕФКЌСППЩгУеєСѓЗЈНјааВтЖЈЃЌеєСѓзАжУШчЭМЫљЪОЃЈМгШШКЭвЧЦїЙЬЖЈзАжУвбТдШЅЃЉЃЌ
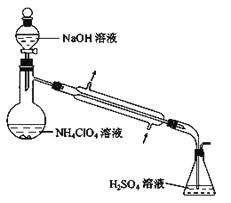
ЪЕбщВНжшШчЯТЃК
ВНжш 1ЃКАДШчЭМзщзАКУвЧЦїЃЌзМШЗГЦШЁбљЦЗ a g ЃЈдМ 0.5gЃЉ гкеєСѓЩеЦПжаЃЌМгШыдМ 150mL ЫЎШмНтЁЃ
ВНжш 2ЃКзМШЗСПШЁ 40.00mL дМ 0.1 molЁЄLЃ1H2SO4 ШмвКгкзЖаЮЦПжаЁЃ
ВНжш 3ЃКОЕЮвКТЉЖЗЯђеєСѓЦПжаМгШы 20mL3molLЃ1NaOH ШмвКЁЃ
ВНжш 4ЃКМгШШеєСѓжСеєСѓЩеЦПжаЪЃгрдМ 100mL ШмвКЁЃ
ВНжш 5ЃКгУаТжѓЗаЙ§ЕФЫЎГхЯДРфФ§зАжУ 2~3 ДЮЃЌЯДЕгвКВЂШызЖаЮЦПжаЁЃ
ВНжш 6ЃКЯђзЖаЮЦПжаМгШыЫсМюжИЪОМСЃЌгУ c molЁЄLЃ1NaOH БъзМШмвКЕЮЖЈжСжеЕуЃЌМЧТМЯћКФNaOH БъзМШмвКЕФЬхЛ§ЁЃ
ВНжш 7ЃКНЋЪЕбщВНжш 1-6 жиИД 2 ДЮЁЃМЧТМЯћКФ NaOH БъзМШмвКЕФЦНОљЬхЛ§ЮЊ V1 mL
ВНжш 8ЃКдкВНжш 1 жаВЛМгШыбљЦЗЃЌНЋЪЕбщВНжш 1-6 жиИД 3 ДЮЁЃМЧТМЯћКФ NaOH БъзМШмвКЕФ ЦНОљЬхЛ§ЮЊ V2 mLЁЃ
ЧыЛиД№ЃК
ЂйВНжш 2 жаЃЌзМШЗСПШЁ 40.00mL H2SO4 ШмвКЕФВЃСЇвЧЦїЪЧ_____ЁЃ
ЂкЮЊШЗБЃАБЦјБЛГфЗжЮќЪеЕФЪЕбщВНжшЮЊ_________ЃЌЮЊЬсИпАБЕФЮќЪеТЪЃЌБОЪЕбщЛЙШБЩйЕФвЛВНЪЕбщЕФВНжшЮЊ_____
ЂлЧыгУКЌзжФИЕФБэДяЪНБэЪОЃЈШчЙћгаЪ§зжЃЌЧыЛЏМђГЩвЛИіЪ§зжЃЉбљЦЗжа NH4ClO4 ЕФКЌСП_____ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПАЂФЊЮїСжЪЧвЛжжзюГЃгУЕФАыКЯГЩЧрУЙЫиРрЙуЦзІТ-ФкѕЃАЗРрПЙЩњЫиЃЌФГбаОПаЁзщАДЯТСаТЗ ЯпКЯГЩЃК
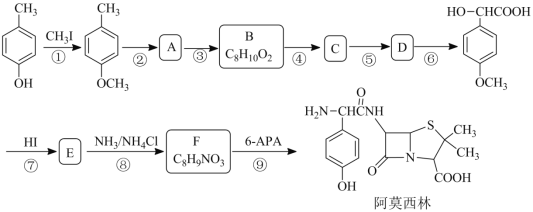
вбжЊ:
![]()
ЧыЛиД№ЃК
ЃЈ1ЃЉB ЕФНсЙЙМђЪНЮЊ_____ЁЃ
ЃЈ2ЃЉЯТСаЫЕЗЈе§ШЗЕФЪЧ_____ЁЃ
A ЛЏКЯЮя B ЕФЙйФмЭХЪЧШЉЛљ B ЗДгІЂйЕФФПЕФЪЧЮЊСЫБЃЛЄЗгєЧЛљ
C ЛЏКЯЮя D ФмЗЂЩњЯћШЅЗДгІ D АЂФЊЮїСжЕФЗжзгЪНЪЧ C16H19N3O5S
ЃЈ3ЃЉаДГіЕкЂсВНЗДгІЕФЛЏбЇЗДгІЗНГЬЪН_____ЁЃ
ЃЈ4ЃЉЩшМЦвд ЮЊдСЯжЦБИЫЎбюЫсЃЈ
ЮЊдСЯжЦБИЫЎбюЫсЃЈ ЃЉЕФКЯГЩТЗЯп ЃЈгУСїГЬЭМБэЪОЃЌЮоЛњЪдМСШЮбЁЃЉ_____ЁЃ
ЃЉЕФКЯГЩТЗЯп ЃЈгУСїГЬЭМБэЪОЃЌЮоЛњЪдМСШЮбЁЃЉ_____ЁЃ
ЃЈ5ЃЉаДГіЭЌЪБЗћКЯЯТСаЬѕМўЕФ F ЕФЫљгаЭЌЗжвьЙЙЬхЕФНсЙЙМђЪН_____ЁЃ
ЂйЗжзгжагаБНЛЗЧвЪЧБНЛЗЕФЖдЮЛЖўШЁДњЮя
ЂкЗжзгжаКЌгаЯѕЛљЧвВЛгыБНЛЗжБНгЯрСЌ
ЂлЗжзгВЛгыН№ЪєФЦЗДгІЗХГіЧтЦј
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
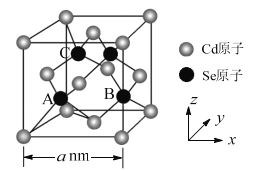
ЁОЬтФПЁП(CdSe)nаЁЭХДиЃЈCdnSenЃЌn=1~16ЃЉЮЊЂђ-ЂізхЛЏКЯЮяАыЕМЬхВФСЯЃЌОпгаЖРЬиЕФЙтбЇКЭЕчбЇаджЪЃЌГЃгІгУгкЗЂЙтЖўМЋЙмЁЂЩњЮяЯЕЭГГЩЯёгыеяЖЯЕШЗНУцЁЃ
ЛиД№ЯТСаЮЪЬтЃК
(1)ЛљЬЌSeдзгЕФМлВуЕчзгХХВМЪНЮЊ___ЁЃ
(2)CdЕФЕквЛЕчРыФмДѓгкЭЌжмЦкЯрСкдЊЫиЃЌдвђЪЧ___ЁЃ
(3)CdSЁЂCdSeЁЂCdTeОљЮЊживЊЕФЂђ-ЂізхЛЏКЯЮяАыЕМЬхВФСЯЃЌШлЕуЗжБ№ЮЊ1750ЁцЁЂ1350ЁцЁЂ1041ЁцЃЌЩЯЪіШлЕуГЪЙцТЩадБфЛЏЕФдвђЪЧ___ЁЃ
(4)РћгУгаЛњХфЬхPH3ЁЂN(CH3)3ЕШаоЪЮ(CdSe)2ПЩИФЩЦЦфЙтжТЗЂЙтаЇТЪЁЃЦфжаPH3ЕФПеМфЙЙаЭЪЧ___ЁЃN(CH3)3жаВЮгыаЮГЩХфЮЛМќЕФЙТЕчзгЖдеМОнЕФЙьЕРЪЧ___ЁЃ
(5)CdSeЕФвЛжжОЇЬхЮЊЩСаППѓаЭНсЙЙЃЌОЇАћНсЙЙШчЭМЫљЪОЁЃЦфжадзгзјБъВЮЪ§AЮЊ(![]() ЃЌ
ЃЌ![]() ЃЌ
ЃЌ![]() )ЃЌдђBЁЂCЕФдзгзјБъВЮЪ§ЗжБ№ЮЊ___ЁЃИУОЇАћжаCdSeМќЕФМќГЄЮЊ___ЁЃвбжЊCdКЭSeЕФдзгАыОЖЗжБ№ЮЊrCdnmКЭrSenmЃЌдђИУОЇАћжадзгЕФЬхЛ§еМОЇАћЬхЛ§ЕФАйЗжТЪЮЊ___ЁЃ
)ЃЌдђBЁЂCЕФдзгзјБъВЮЪ§ЗжБ№ЮЊ___ЁЃИУОЇАћжаCdSeМќЕФМќГЄЮЊ___ЁЃвбжЊCdКЭSeЕФдзгАыОЖЗжБ№ЮЊrCdnmКЭrSenmЃЌдђИУОЇАћжадзгЕФЬхЛ§еМОЇАћЬхЛ§ЕФАйЗжТЪЮЊ___ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЂёЁЂCu2O ЙуЗКгІгУгкЬЋбєФмЕчГиСьгђЁЃвд CuSO4ЁЂNaOH КЭПЙЛЕбЊЫсЮЊдСЯЃЌПЩжЦБИ Cu2OЁЃ
ЃЈ1ЃЉCu2+ЛљЬЌКЫЭтЕчзгХХВМЪНЮЊ________ЁЃ
ЃЈ2ЃЉSO4 2ЉЕФПеМфЙЙаЭЮЊ_________ЃЈгУЮФзжУшЪіЃЉЃЌCu2+гы OH-ЗДгІФмЩњГЩ[Cu(OH)4 ]2-ЃЌ [Cu(OH)4]2-жаЕФХфЮЛдзгЮЊ_______ЃЈЬюдЊЫиЗћКХЃЉЁЃ
ЃЈ3ЃЉПЙЛЕбЊЫсЕФЗжзгНсЙЙШчЭМ 1 ЫљЪОЃЌЗжзгжаЬМдзгЕФЙьЕРдгЛЏРраЭЮЊ________ЃЛЭЦВтПЙЛЕбЊЫсдкЫЎжаЕФШмНтадЃК_______ЃЈЬюЁАФбШмгкЫЎЁБЛђЁАвзШмгкЫЎЁБЃЉЁЃ
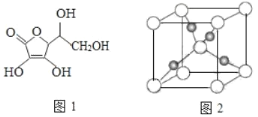
ЃЈ4ЃЉвЛИі Cu2O ОЇАћЃЈШчЭМ 2ЃЉжаЃЌCu дзгЕФЪ§ФПЮЊ_________ЁЃ
ЂђЁЂСзЫсбЧЬњяЎЃЈLiFePO4ЃЉПЩгУзїяЎРызгЕчГие§МЋВФСЯЃЌОпгаШШЮШЖЈадКУЁЂбЛЗадФмгХСМЁЂАВШЋадИпЕШЬиЕуЃЌЮФЯзБЈЕРПЩВЩгУ FeCl3ЁЂNH4H2PO4ЁЂLiCl КЭБНАЗЕШзїЮЊдСЯжЦБИЁЃЛиД№ЯТСаЮЪЬтЃК
ЃЈ5ЃЉдкжмЦкБэжаЃЌгы Li ЕФЛЏбЇаджЪзюЯрЫЦЕФСкзхдЊЫиЪЧ___ЃЌИУдЊЫиЛљЬЌдзгКЫЭт MВуЕчзгЕФзда§зДЬЌ_______ЃЈЬюЁАЯрЭЌЁБЛђЁАЯрЗДЁБЃЉЁЃ
ЃЈ6ЃЉБНАЗЃЈ![]() ЃЉЕФОЇЬхРраЭЪЧ_________ЁЃБНАЗгыМзБНЃЈ
ЃЉЕФОЇЬхРраЭЪЧ_________ЁЃБНАЗгыМзБНЃЈ ![]() ЃЉЕФЯрЖдЗжзгжЪСПЯрНќЃЌЕЋБНАЗЕФШлЕуЃЈ-5.9ЁцЃЉЁЂЗаЕуЃЈ184.4ЁцЃЉЗжБ№ИпгкМзБНЕФШлЕуЃЈ-95.0ЁцЃЉЁЂЗаЕуЃЈ110.6ЁцЃЉЃЌдвђЪЧ________ЁЃ
ЃЉЕФЯрЖдЗжзгжЪСПЯрНќЃЌЕЋБНАЗЕФШлЕуЃЈ-5.9ЁцЃЉЁЂЗаЕуЃЈ184.4ЁцЃЉЗжБ№ИпгкМзБНЕФШлЕуЃЈ-95.0ЁцЃЉЁЂЗаЕуЃЈ110.6ЁцЃЉЃЌдвђЪЧ________ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com