
【题目】下列乙醇的化学性质中不是由羟基所决定的是( )
A.跟活泼金属Na等发生反应
B.在足量O2中完全燃烧生成CO2和水
C.当Ag或Cu存在时跟O2发生反应生成乙醛和H2O
D.乙醇被酸性高锰酸钾氧化为乙酸
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】短周期M、N两种元素对应的简单离子分别为mMa+、n Nb-,若离子的核外电子排布相同,则下列关系不正确的是( )
A. 原子半径:M < NB. 离子半径:M < N
C. 原子序数:M > ND. 主族序数:M < N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于铝的性质,错误的说法是( )
A.铝的表面能形成致密的氧化膜,因此铝难腐蚀
B.铝能溶解于冷的浓硝酸氧化成为硝酸铝
C.铝能溶解于NaOH溶液生成偏铝酸钠和氢气
D.铝能在氯气中燃烧,生成氯化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.现有常温下pH=2的HCl溶液甲和pH=2的CH3COOH溶液乙,请根据下列操作回答问题:
(1)常温下0.1mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是_____。
A.c(H+) B.![]() C.c(H+)·c(OH-)
C.c(H+)·c(OH-)
(2)取10mL的乙溶液,加入等体积的水,CH3COOH的电离平衡________(填“向左”“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中![]() 的比值将________(填“增大”“减小”或“无法确定”)。
的比值将________(填“增大”“减小”或“无法确定”)。
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗NaOH溶液体积的大小关系为V(甲)________(填“>”“<”或“=”)V(乙)。
(4)已知25℃时,下列酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=4.7×10-11 | 3.0×10-8 |
下列四种离子结合H+能力最强的是________。
A.HCO B.CO![]() C.ClO- D.CH3COO-
C.ClO- D.CH3COO-
写出下列反应的离子方程式:HClO+Na2CO3(少量):______________________
II.室温下,0.1 mol·L-l的KOH溶液滴10.00mL 0.10 mol·L-l H2C2O4 (二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:
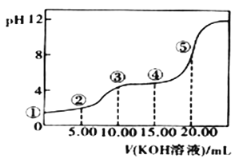
(5)点③所示溶液中所有离子的浓度由大到小的顺序为:________________________。点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4)+c(C2O42)=________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸铁晶体Fe2(C2O4)3·xH2O可溶于水,且能做净水剂。为测定该晶体中铁的含量,做了如下实验:
步骤1:称量5.6g草酸铁晶体,配制成250 mL一定物质的量浓度的溶液。
步骤2:取所配溶液25.00 mL于锥形瓶中,先加足量稀H2SO4酸化,再滴加KMnO4溶液,反应为:2KMnO4+5H2C2O4+3H2SO4═ K2SO4+2MnSO4+10CO2↑+8H2O。向反应后的溶液加锌粉,加热至黄色刚好消失,过滤、洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
步骤3:用0.0200 mol/LKMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液V1 mL,滴定中MnO4-被还原成Mn2+。
重复步骤2、步骤3的操作2次,分别滴定消耗0.0200 mol/LKMnO4溶液为V2、V3 mL。
记录数据如下表:
实验编号 | KMnO4溶液的浓度(mol/L) | KMnO4溶液滴入的体积(mL) |
1 | 0.0200 | V1 = 20.02 |
2 | 0.0200 | V3 = 19.98 |
3 | 0.0200 | V2 = 23.32 |
请回答下列问题:
(1)草酸铁溶液能做净水剂的原因______________________________(用离子方程式表示)。
(2)步骤2加入酸性高锰酸钾的作用_________________________________________________。
(3)加入锌粉的目的是______________________________。
(4)步骤3滴定时滴定终点的判断方法是_____________________________________________。
(5)在步骤3中,下列滴定操作使测得的铁含量偏高的有______。
A.滴定管用水洗净后直接注入KMnO4溶液
B.滴定管尖嘴内在滴定前有气泡,滴定后气泡消失
C.读取KMnO4溶液体积时,滴定前平视,滴定结束后仰视读数
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出.
(6)实验测得该晶体中铁的含量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓硫酸分别和三种钠盐反应,下列分析正确的是

A. 对比①和②可以说明还原性Br->Cl-
B. ①和③相比可说明氧化性Br2>SO2
C. ②中试管口白雾是HCl遇水蒸气所致,说明酸性H2SO4>HCl
D. ③中浓H2SO4被还原成SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校购买的硫酸试剂标签上的部分内容.据此下列说法正确的是( )

A. 该硫酸的物质的量浓度为1.84mol/L
B. 1mol Zn与足量的该硫酸反应产生2gH2
C. 配制200mL 4.6mol/L的稀硫酸需取该硫酸50mL
D. 该硫酸与等体积的水混合所得溶液的物质的量浓度等于9.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近两年流行喝果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品。苹果酸(2-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构简式如图,下列说法不正确的是( )
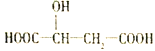
A. 苹果酸在一定条件下能发生酯化反应
B. 苹果酸在一定条件下能发生催化氧化反应
C. 1mol苹果酸与足量金属钠反应最多可以产生1.5mol H2
D. 1mol苹果酸与NaHCO3溶液反应最多消耗3mol NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中可以提取很多有用的物质,例如从海水制盐所得到的卤水中可以提取碘。活性炭吸附法是工业提碘的方法之一,其流程如下:

资料显示:Ⅰ.pH=2时,NaNO2溶液只能将I-氧化为I2,同时生成NO;
Ⅱ.I2+5Cl2+6H2O=2HIO3+10HCl;
Ⅲ.5SO32-+2IO3-+2H+=I2+5SO42-+H2O;
Ⅳ.I2在碱性溶液中反应生成I-和IO3-。
(1)反应①的离子方程式_____________。
(2)方案甲中,根据I2的特性,分离操作X的名称是________________。
(3)已知:反应②中每吸收3molI2转移5mol电子,其离子方程式是_______________。
(4)Cl2、酸性KMnO4等都是常用的强氧化剂,但该工艺中氧化卤水中的I-却选择了价格较高的NaNO2,原因是_______________。
(5)方案乙中,已知反应③过滤后,滤液中仍存在少量的I2、I-、IO3-。请分别检验滤液中的I-、IO3-,将实验方案补充完整。实验中可供选择的试剂:稀H2SO4、淀粉溶液、Fe2(SO4)3溶液、Na2SO3溶液
A.滤液用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在。
B._______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com