
【题目】如图所示①②③三个容器,①②容器体积均为VL,③体积为0.5VL,若起始温度相同,分别向①②通入2molA,向③中通入2molB,发生如下反应:2A(g)![]() B(g) △H<0,则达到平衡时各容器内B的体积分数由大到小的顺序为( )
B(g) △H<0,则达到平衡时各容器内B的体积分数由大到小的顺序为( )
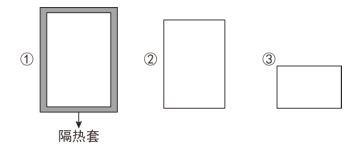
A.①②③
B.③①②
C.③②①
D.②③①
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列说法正确的是( )
A.20gH218O和D2O的混合物中含有中子10NA
B.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
C.1L0.1mol·L-1的Na2CO3溶液中HCO3-和CO32-离子数之和为0.1NA
D.pH=1的硫酸溶液,含有氢离子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.2.0gD2中含有的中子数目为0.8NA
B.4.6gC2H6O中含有C—H键的数目一定为0.6NA
C.11.2L(标准状况)由甲烷和乙烯组成的混合气体中含有氢原子数目为2NA
D.常温下,将2.8gFe置于足量的浓硝酸中,转移的电子数目—定为0.15NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化苯(基)硒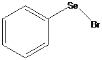 有剧毒,是一种合成有机硒化合物的重要中间体。可由乙酸基笨基硒在四氯化碳中与溴反应经乙酸处理得到,回答下列问题:
有剧毒,是一种合成有机硒化合物的重要中间体。可由乙酸基笨基硒在四氯化碳中与溴反应经乙酸处理得到,回答下列问题:
(1)Br原子核外能量高的能层符号是__________,其基态原子价电子排布式为_______。
(2)C、N、O三种原子的第一电离能由大到小的顾序为_______。
(3)乙酸分子中碳原子的杂化方式为_______。
(4) H2Se的沸点_______(填“>”“<”或“=”)H2S,原因是_______。
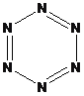
(5)晶体氮(N6)的结构如下图所示,其熔点为70℃,晶体氮中存在的作力有_______。
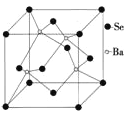
(6)BaSe可用于光电池,其晶胞结构如上图所示,晶胞参数a=0.786nm,NA代表阿伏加徳罗常数,列式计算BaSe晶胞密度为____gcm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.60g冰醋酸和果糖的混合物中含氧原子的数目为2NA
B.标准状况下,33.6LCHCl3中含有的共价键的数目为6NA
C.常温下,将2.7gAl投入足量的浓硝酸中,转移电子数为0.3NA
D.78gH2SiO3胶体中含有的胶粒数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用KMnO4和浓盐酸反应制取氯气。
KMnO4+HCl(浓)=KCl+MnCl2+Cl2↑+H2O(未配平)
(1)配平化学方程式,并用单线桥标出电子转移的方向和数目。
(2)将上述配平的化学方程式改写为离子方程式 。
(3)浓盐酸在反应中显示出来的性质是________________
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(4)若产生0.5molCl2,则被氧化的HCl mol,转移的电子的数目约为___________。
(5)一定条件下,KMnO4还可以氧化其他还原性物质。
MnO4-+C2O42-+ = Mn2+ +CO2↑+
完成上述离子方程式,此反应中,发生氧化反应的物质是 ;若转移1mol电子,生成标准状况下CO2 L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明在实验室制备得到的Cl2中会混有HCl,甲同学设计了如图所示的实验装置,按要求回答下列问题。
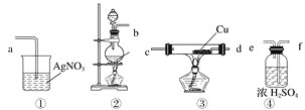
(1)请根据甲同学的示意图,所需实验装置从左至右的连接顺序:装置②→__________。
(2)装置②中主要玻璃仪器的名称__________、__________、__________。
(3)实验室制备Cl2的离子方程式为____________。
(4)装置③中Cu的作用__________(用化学方程式表示)。
(5)乙同学认为甲同学实验设计仍然存在缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为此,乙同学提出气体通入装置①之前,要加装一个检验装置⑤,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置⑤应放入__________。
(6)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成紫色石蕊试液,如果观察到__________的现象,则证明制Cl2时有HCl挥发出来。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲乙同学通过如下实验探究乙烯的部分化学性质。
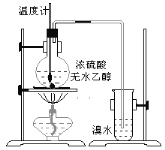
(1)实验室制乙烯的化学方程式是__________________,乙烯使溴水褪色的化学反应类型是______________。
(2)甲同学观察到当温度升到100℃左右时,无色液体开始变色,到160℃左右时,混合液全呈黑色,此黑色物质是_________;超过170℃后生成气体速度明显加快并伴有刺激性气味气体产生,这种刺激性气味气体是_________,该气体的存在不能认为溴水褪色是乙烯的加成反应造成的,原因是(用化学方程表示):________________________。
(3)乙同学经分析认为可能还有CO、CO2两种气体产生。为检验CO是否存在,他设计了如下装置。

装置a的作用是_________________,浓溴水的作用是______________,稀溴水的作用是________________。实验发现最后气体经点燃是蓝色火焰,确认有一氧化碳。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图ⅠⅣ所示。

(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的是(填装置序号)___。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为___;与实验Ⅲ相比,实验Ⅳ的优点是(填选项序号)___。
A.Ⅳ比Ⅲ复杂
B.Ⅳ比Ⅲ安全
C.Ⅳ比Ⅲ操作简便
D.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是(填化学式)___。
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应,
①当石灰水过量时,其离子方程式为:___;
②当碳酸氢钠与氢氧化钙物质的量之比为2:1时,所得溶液中溶质的化学式为___,请设计实验检验所得溶液中溶质的阴离子___。
(5)已知NaHCO3溶液呈碱性,则在该溶液中c(H2CO3)______c(CO32-),其原因是:__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com