
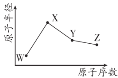
【题目】X、Y、W、Z 是四种常见短周期元素,其原子半径随原子序数变化如图所示。已知 W的一种核素的质量数为 18,中子数为 10,X 和Ne 原子的核外电子总数相差 1;Y 的单质是一种常见的半导体材料;Z 的非金属性在同周期主族元素中最强。下列说法正确的是
A.最高化合价:X>Y>Z>W
B.简单气态氢化物的稳定性:Y>W
C.Y 的氧化物与 X、Z 的最高价氧化物对应的水化物均能反应
D.由 X、Z、W 三种元素形成的化合物一定既含有离子键又含有共价键
【答案】D
【解析】
W的一种核素的质量数为18,中子数为10,则W为O元素;X 和Ne 原子的核外电子总数相差1,再参照图中X的原子半径,可确定X为Na元素;Y 的单质是一种常见的半导体材料,则Y为Si元素;Z 的非金属性在同周期主族元素中最强,参照Z的原子半径,则Z为Cl元素。
由以上分析可知,X、Y、W、Z分别为Na、Si、O、Cl元素。
A.Z(Cl)的最高化合价可达+7价,Y(Si)可达+4价,O一般不表现正价,Na显+1价,A不正确;
B.非金属性Si<O,则简单气态氢化物的稳定性:SiH4<H2O,B不正确;
C.Y 的氧化物为SiO2,与 Na的最高价氧化物对应的水化物NaOH能反应,但与HClO4不能反应,C不正确;
D.由 X、Z、W 三种元素形成的化合物可能为NaClO、NaClO2、NaClO3、NaClO4,都含有离子键和有共价键,D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】已知断裂1mol化学键吸收的能量或形成1mol化学键释放的能量称为键能,部分物质的键能如下表所示:甲醛结构式为:![]() ,甲醛制备乌洛托品(C6H12N4)的反应如下,该反应的△H为( )
,甲醛制备乌洛托品(C6H12N4)的反应如下,该反应的△H为( )
6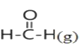 +4NH3(g)→
+4NH3(g)→ +6H2O(l)
+6H2O(l)
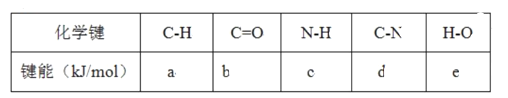
A. 6(a+b+c-d-e) kJ·mol-1B. 6(d+e-a-b-c) kJ·mol-1
C. 6(b+2c-2d-2e) kJ·mol-1D. 6(2d+2a+2e-b-3c) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化六氨合钴(III)([Co(NH3)6]Cl3 是合成其他含钴配合物的重要原料。在活性炭的催化作用下,通过氧化二氯化六氨合钴(II)得到三氯化六氨合钴(III)制备流程如下:
![]()
资料:
①钴离子常见价态有+2(II)价,+3(III)价,Co(II)离子能在水溶液中稳定存在,但 Co(III)离子不能稳定存在,只能以固态或络合物形式(如[Co(NH3)6]3+)稳定存在溶液中。
② Co2+在 pH=9.4 时完全沉淀为 Co(OH)2
(1) 实验中需要将 CoCl2·6H2O 晶体研细,其目的是:__________________。
(2)在加入浓氨水前先加入大量 NH4Cl溶液,请结合平衡原理解释原因______________________。
(3)在“氧化”过程中需水浴控温在 50~60℃,温度不能过高,原因是______________________。
(4)写出“氧化”过程中反应的离子方程式_______________。
(5)为测定产品中钴的含量,进行下列实验:
①称取样品 4.000 g 于烧瓶中,加水溶解,加入足量的 NaOH 溶液,加热至沸 15~20 min,将 [Co(NH3)6]Cl3 完全转化为 Co(OH)3,冷却后加入足量 KI 固体和 HCl 溶液,充分反应一段时间后,将烧瓶中的溶液全部转移至 250.00 mL 容量瓶中,加水定容,取其中 25.00 mL 试样加入到锥形瓶中;
②用 0.100 0 mol·L -1 Na2S2O3 标准溶液滴定,溶液变为浅黄色后,加入淀粉溶液作指示剂继续滴定至终点,重复 2 次实验,测得消耗 Na2S2O3 溶液的平均体积为 15.00 mL。(已知:2Co3++2I-=2Co2++I2 ,I2 +2S2O32-=2I-+S4O62-).通过计算确定该产品中钴的含量___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO)俗称蚁醛,是一种重要的有机原料。
I.利用甲醇(CH3OH)制备甲醛
脱氢法:CH3OH(g)=HCHO(g)+H2(g) △H1 = +92.09kJ/mol
氧化法:CH3OH(g) +1/2O2(g)=HCHO(g)+H2O(g) △H2
(1)已知:2H2(g)+O2(g)=2H2O(g) △H3=-483.64 kJ/mol,则△H2=_______。
(2)与脱氢法相比,氧化法在热力学上趋势较大,其原因为_______________。
(3)图1为甲醇制备甲醛反应的lg K(K为平衡常数)随温度(T)的变化曲线。曲线____(填“a”或“b”)对应脱氢法,判断依据为_________________。

II.甲醛的用途
(4)将甲醛水溶液与氨水混合蒸发可制得乌洛托品(结构简式如图2),该物质在医药等工业中有广泛用途。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为_______。
(5)将甲醛水溶液与硫酸镍(NiSO4)混合,可用于化学镀镍。若反应过程中有CO2产生,则该反应的离子方程式为____________________。
Ⅲ.甲醛的检测
(6)室内甲醛超标会危害人体健康,通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图3所示,则b极的电极反应式为_________,当电路中转移4×10-4 mol电子时,传感器内参加反应的HCHO为_______mg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数值。下图表示 N2O 在Pt2O+表面与 CO 反应转化成无害气体的过程。下列说法正确的是
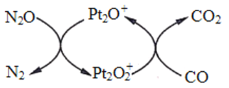
A.N2O 转化成无害气体时的催化剂是![]() B.1g N2O 气体中含有电子数为 0.5NA
B.1g N2O 气体中含有电子数为 0.5NA
C.1mol CO2 中含有 2NA 个共用电子对D.1mol Pt2O+转化为 ![]() 得电子数为 3NA
得电子数为 3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧熔融碳酸盐燃料电池是一种高温电池(600~700℃),具有效率高、噪音低、无污染、燃料多样、余热利用价值高等优点。氢氧熔融碳酸盐燃料电池的工作原理如图所示。下列有关该电池的说法正确的是
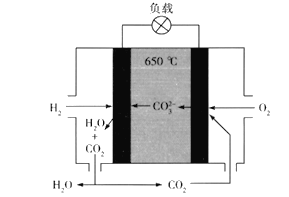
A. 电池工作时,熔融碳酸盐只起到导电的作用
B. 负极反应式为H2 -2e- +CO32-==CO2+H2O
C. 该电池可利用工厂中排出的CO2,减少温室气体的排放
D. 电池工作时,外电路中流过0.2 mol电子,消耗3.2 g O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种黄酮类化合物的中间体,其结构简式如图所示。下列有关化合物X的说法正确的是( )
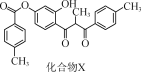
A.分子中所有碳原子共平面
B.分子中存在1个手性碳原子
C.化合物X不能使酸性KMnO4溶液褪色
D.1 mol化合物X最多可与12 mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A.13 g13 C含有的中子数目为6 NA
B.常温下 ,I LpH =4的醋酸溶液所含离子总数为2 ×10-4NA
C.100 g质量分数为 98% 的磷酸中所含氧原子总数为4 NA
D.0.1 mol Fe 完全溶于稀硝酸,转移的电子数目为0.3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向2L密闭容器中加入2molN2和10molH2,发生反应N2(g)+3H2(g)![]() 2NH3(g),2min时测得剩余N2为1mol,下列化学反应速率表示不正确的是( )
2NH3(g),2min时测得剩余N2为1mol,下列化学反应速率表示不正确的是( )
A. v(N2)=0.25 mol·L-1·min-1
B. v(H2)=0.75 mol·L-1·min-1
C. v(NH3)=1 mol·L-1·min-1
D. v(NH3)=0.5 mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com