
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻 璃粉末(含SiO2、Fe2O3、CeO2等物质)。某课题小组以此粉末为原料,设计资源回收的工艺流程如下: 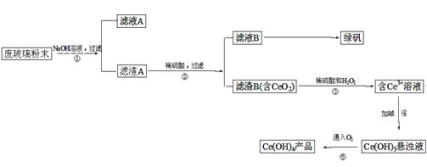
(1)写出第①步反应的离子方程式。
(2)洗涤滤渣B的目的是为了除去(填离子符号),检验该离子是否洗净的方法是。
(3)写出第③步反应的化学方程式。
(4)制备绿矾(FeSO4·7H2O)时,向Fe2(SO4)3溶液中加入过量铁屑,充分反应后,经过滤得到FeSO4溶液,再经、、过滤、洗涤、干燥等操作步骤得到绿矾。
(5)取上述流程中得到的Ce(OH)4产品(质量分数为86%)1.000g,加硫酸溶解后,用0.1000mol/L FeSO4溶液滴定至终点(铈被还原成Ce3+),则需准确滴加标准溶液的体积为mL。
【答案】
(1)SiO2+2OH-=SiO+H2O
(2)Fe3+;取最后一次洗涤液少许,加入KSCN溶液,若不出现红色则已洗净,若出现红色则未洗净
(3)2CeO2+ H2O2 +3H2SO4 = Ce2(SO4)3 + O2↑+ 4H2O
(4)蒸发浓缩;冷却结晶
(5)43.14
【解析】解:(1)根据废玻璃粉末的成分(含SiO2、Fe2O3、CeO2等物质),可知能与氢氧化钠反应的是二氧化硅.其离子方程式为SiO2+2OH-═SiO32-+H2O,
所以答案是:SiO2+2OH-═SiO32-+H2O;
(2)经分析滤渣A的成分是Fe2O3、CeO2;第②步反应Fe2O3与稀硫酸作用生成Fe2(SO4)3 , 洗涤滤渣B的目的显然是为了除去 Fe3+ , 检验铁离子是否洗净的方法是取最后一次洗涤液,加入KSCN溶液,若不出现红色,则已洗净,否则未洗净,
所以答案是:Fe3+;取最后一次洗涤液,加入KSCN溶液,若不出现红色,则已洗净,否则未洗净;
(3)第③步反应CeO2与H2O2和稀H2SO4反应生成Ce3+ , Ce元素由+4价变为+3价,被还原;则H2O2应被氧化生成O2 , 然后配平得出第③步反应的化学方程式 2CeO2+H2O2+3H2SO4═2Ce2(SO4)3+O2↑+4H2O;
所以答案是:2CeO2+H2O2+3H2SO4═Ce2(SO4)3+O2↑+4H2O;
(4)绿矾(FeSO47H2O)是结晶水合物,固体加热易分解;故由FeSO4溶液制备绿矾(FeSO47H2O)时,应经蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作步骤得到,
所以答案是:蒸发浓缩;冷却结晶;
(5)由已知条件:取上述流程中得到的Ce(OH)4产品(质量分数为86%)1.000g,加硫酸溶解后得Ce4+ , 用0.1000mol/LFeSO4溶液滴定至终点,铈被还原成Ce3+ , 则Fe2+被氧化为Fe3+ , 反应关系式为:Ce(OH)4~Ce3+~e-~Fe2+~Fe3+ , 则n(Ce(OH)4)=n(FeSO4)=1.000g×86%÷208g/mol=0.004314mol,滴加标准溶液的体积V=![]() =0.04314L=43.14mL,
=0.04314L=43.14mL,
所以答案是:43.14.


科目:高中化学 来源: 题型:
【题目】下列各溶液中所含的Cl-与1molCaCl2溶液中Cl-数目相同的是
A.2molZnCl2B.1molKClC.1molMgCl2D.2molNaClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铜电极的叙述中不正确的是( )
A.用电解法精炼粗铜时,粗铜作阳极
B.在原电池中,铜电极只能作正极
C.在镀件上镀铜时,金属铜作阳极
D.锌铜原电池(稀硫酸为电解质溶液),铜极上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组比较中,错误的是( )
A.半径:F﹣>Na+>Mg2+>A13+B.热稳定性:PH3>H2S>HCl
C.酸性:HClO4>H2SO4>H3PO4D.氧化性:F2>C12>Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中有关微粒的物质的量浓度关系正确的是( )
A.等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)═c(SO ![]() )>c(NH
)>c(NH ![]() )>c(OH﹣)>c(H+)
)>c(OH﹣)>c(H+)
B.常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7:c(Na+)>c(CH3COOH)═c(Cl﹣)
C.物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO﹣)═2c(HCO3﹣)+2c(H2CO3)+2c(CO ![]() )
)
D.pH=1的NaHSO4溶液:c(H+)═2c(SO ![]() )+c(OH﹣)
)+c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g/mL),所得溶液的密度为ρ g/mL,质量分数为ω,物质的量浓度为c mol/L,则下列关系中不正确的是( )
A. ρ=(17V+22 400)/(22.4+22.4V)
B. ω=17c/(1 000ρ)
C. ω=17V/(17V+22 400)
D. c=1 000Vρ/(17V+22 400)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com