
【题目】某过碳酸钠(Na2CO4)中含有少量过氧化钠,甲、乙两位同学各称取一定质量的该样品,并用如下图所示仪器测定样品的纯度。
仪器的连接顺序,甲同学:⑤-⑧-③-⑦-④; 乙同学:⑤-③-②

已知:过碳酸钠(Na2CO4)、过氧化钠分别跟足量稀硫酸反应的化学方程式如下:
2Na2CO4 + 2H2SO4===2Na2SO4 + 2CO2↑+ O2↑+ 2H2O
2Na2O2 + 2H2SO4===2Na2SO4 + O2↑+ 2H2O
(1)甲同学想通过实验测得的数据是 ,他选用的装置 (填序号)是没有必要的。实验中甲同学测得气体体积为VL(20 ℃,1大气压),计算时他未将VL换算到标准状况,则他得到的Na2CO4的质量分数________。(填“偏高”或“偏低”)
(2)乙同学想通过实验测得的数据是 ,按他测得的数据计算出的实验结果有可能偏高,原因是 ,也有可能偏低,原因是 。
(3)为了测得准确的实验数据,请你将乙同学的实验设计进行改进,写出你所选用仪器的连接顺序(每种仪器最多使用一次,也可以不用) 。(填序号)
【答案】生成的氧气的体积③偏低生成的二氧化碳的质量空气中的水与二氧化碳进入②增重使结果偏大产生的二氧化碳在装置⑤、③及导管中没有完全被②吸收使结果偏小⑩①③②⑨
【解析】(1)过碳酸钠和硫酸反应生成二氧化碳和氧气,甲同学通过⑤-⑧-③-⑦-④的步骤进行实验,可用⑧吸收二氧化碳,通过测量氧气的体积可确定含量,用排水法收集氧气,气体无需干燥,则装置③没有必要,实验中甲同学测得气体体积为VL(20℃,1大气压),计算时他未将VL换算到标准状况,测定氧气体积比标准状况大,则他得到的Na2CO4的质量分数偏低;故答案为:生成的氧气的体积;③;偏低;
(2)乙同学:⑤-③-②,用碱石灰吸收二氧化碳,根据二氧化碳的质量可确定含量,但空气中的水与二氧化碳进入②增重使结果偏大;故答案为:生成的二氧化碳的质量,空气中的水与二氧化碳进入②增重使结果偏大;产生的二氧化碳在装置⑤、③及导管中没有完全被②吸收使结果偏小;
(3)应在②后面连接⑨,防止空气中的水、二氧化碳进入②,且使装置内气体全部被吸收,应通氮气,把生成的二氧化碳赶入后边的装置完全吸收,以减少误差;仪器的连接顺序⑩①③②⑨.故答案为:⑩①③②⑨。


科目:高中化学 来源: 题型:
【题目】某无色溶液中含有Mg2+、Al3+、Fe3+、Cu2+、NH4+、 Na+中的一种或几种, 取100mL该溶液,向其中不断滴加某浓度的NaOH溶液,产生的沉淀随着NaOH体积变化的关系如图所示, 则下列叙述不正确的是( )

A. 该溶液中一定不含Fe3+、Cu2+
B. a点到b点,没有发生化学反应
C. 所加NaOH溶液物质的量浓度为1mol/L
D. 该溶液中一定含有Mg2+、Al3+、NH4+,且三者物质的量浓度之比为1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】宝鸡被誉为“青铜器之乡”,出土了大盂鼎、毛公鼎、散氏盘等五万余件青铜器。研究青铜器(含Cu、Sn等)在潮湿环境中发生的腐蚀对于文物保护和修复有重要意义。下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图,下列说法不正确的是

A. 青铜器发生电化学腐蚀,图中c作负极,被氧化
B. 正极发生的电极反应为O2+ 4e-+2H2O=4OH-
C. 环境中的Cl- 与正、负两极反应的产物作用生成a的离子方程式为2Cu2++3OH-+Cl-=Cu2 (OH)3Cl↓
D. 若生成0.2 mol Cu2(OH)3Cl,则理论上消耗的O2体积为4.48L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于溶液和胶体的叙述,正确的是
A. 溶液是电中性的,胶体是带电的
B. 通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动
C. 溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动
D. 一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四个集气瓶中分别充满了Cl2、O2、H2、HCl四种气体中的一种。A瓶中的气体是黄绿色;C和A中的气体混合见光会爆炸;将D瓶的瓶盖打开,在潮湿空气中会出现白雾。根据以上现象判断各瓶中的气体分别是:
a.;b.;c.;d.。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)联氨分子的电子式为_____________,其中氮的化合价为____________。
(2)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为___________。
(3)①2O2(g)+N2(g)=N2O4(l) △H1
②N2(g)+2H2(g)=N2H4(l) △H2
③O2(g)+2H2(g)=2H2O(g) △H3
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) △H4=-1048.9kJ./mol
上述反应热效应之间的关系式为△H4=_____________,联氨和N2O4可作为火箭推进剂的主要原因为_______________ ____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列条件下,一定能大量共存的离子组是
A.无色透明的水溶液中:K+、Mg2+、I-、MnO4-
B.有SO42-存在的溶液中:Na+、Mg2+、Ca2+、I-
C.在强碱溶液中:Na+、K+、CO32-、NO3-
D.在强酸性溶液中:K+、HCO3-、SO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
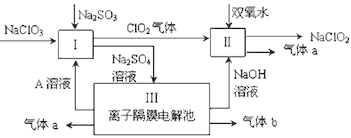
⑴ Ⅰ中发生反应的化学方程式是________________________,氧化剂与还原剂的物质的量之比是____________________;
⑵ Ⅱ中反应的离子方程式是_________________________;
⑶ 装置Ⅲ中阳极的反应是_________________________;
⑷ ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:
5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O
① 该反应中盐酸的作用是__________;② 写出实验室制氯气的离子方程式______________;说明上述两反应中盐酸作用不同的原因___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com