
【题目】亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
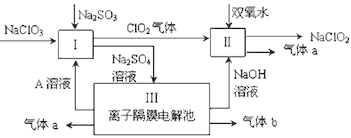
⑴ Ⅰ中发生反应的化学方程式是________________________,氧化剂与还原剂的物质的量之比是____________________;
⑵ Ⅱ中反应的离子方程式是_________________________;
⑶ 装置Ⅲ中阳极的反应是_________________________;
⑷ ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:
5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O
① 该反应中盐酸的作用是__________;② 写出实验室制氯气的离子方程式______________;说明上述两反应中盐酸作用不同的原因___________________________。
【答案】2NaClO3+ Na2SO3+ H2SO4=2Na2SO4 + 2ClO2↑+ H2O2 : 12ClO2+ H2O2+ 2OH-= 2ClO2- + O2↑+ 2H2O4OH-- 4e-==2H2O + O2↑起酸的作用MnO2+4H+ + 2Cl-=Mn2++Cl2↑+2H2O盐酸浓度越大,还原性越强
【解析】(1)由流程图可知反应Ⅰ,反应物为NaClO3、Na2SO3、加入A溶液,产生C1O2、Na2SO4溶液,反应的化学方程式为2NaClO3+ Na2SO3+ H2SO4=2Na2SO4 + 2C1O2↑+ H2O,所以Na2SO3具有还原性,是还原剂,NaClO3是氧化剂,氧化剂与还原剂的物质的量之比是2:1,故答案为:2NaClO3+ Na2SO3+ H2SO4=2Na2SO4 + 2C1O2↑+ H2O;2:1;
(2)Ⅱ中反应根据流程信息可知,生成NaClO2,所以一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生,反应中ClO2是氧化剂,发生还原反应,H2O2是还原剂,发生氧化反应,根据电子转移守恒可知4n(ClO2)=n(HCl),所以反应的离子方程式为2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O,故答案为:2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O;
(3)Ⅲ为电解硫酸钠本质是电解水,阴极2H++2e-=H2↑,阳极4OH--4e-=O2↑+2H2O, 故答案为:4OH--4e-=O2↑+2H2O;
⑷ ①5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O反应中,4NaClO2→4ClO2,+3价的氯元素化合价升高到+4价,所以NaClO2是还原剂;1NaClO2→1NaCl,+3价的氯元素的化合价降低到-1价,所以部分NaClO2作氧化剂,反应中盐酸既不是氧化剂也不是还原剂,只起了酸的作用,故答案为:起酸的作用;
②实验室用二氧化锰和浓盐酸制备氯气,反应的离子方程式为MnO2+4H+ + 2Cl-=Mn2++Cl2↑+2H2O,反应中盐酸是酸和还原剂,上述两反应中盐酸作用不同的原因是盐酸浓度越大,还原性越强,故答案为:MnO2+4H+ + 2Cl-=Mn2++Cl2↑+2H2O;盐酸浓度越大,还原性越强。


科目:高中化学 来源: 题型:
【题目】某过碳酸钠(Na2CO4)中含有少量过氧化钠,甲、乙两位同学各称取一定质量的该样品,并用如下图所示仪器测定样品的纯度。
仪器的连接顺序,甲同学:⑤-⑧-③-⑦-④; 乙同学:⑤-③-②

已知:过碳酸钠(Na2CO4)、过氧化钠分别跟足量稀硫酸反应的化学方程式如下:
2Na2CO4 + 2H2SO4===2Na2SO4 + 2CO2↑+ O2↑+ 2H2O
2Na2O2 + 2H2SO4===2Na2SO4 + O2↑+ 2H2O
(1)甲同学想通过实验测得的数据是 ,他选用的装置 (填序号)是没有必要的。实验中甲同学测得气体体积为VL(20 ℃,1大气压),计算时他未将VL换算到标准状况,则他得到的Na2CO4的质量分数________。(填“偏高”或“偏低”)
(2)乙同学想通过实验测得的数据是 ,按他测得的数据计算出的实验结果有可能偏高,原因是 ,也有可能偏低,原因是 。
(3)为了测得准确的实验数据,请你将乙同学的实验设计进行改进,写出你所选用仪器的连接顺序(每种仪器最多使用一次,也可以不用) 。(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳生活”是指减少能源消耗、节约资源,从而减少二氧化碳排放的生活方式。下列不符合“低碳生活”的做法是
A.节能灯代替白炽灯 B.太阳能热水器代替燃气热水器
C.纸巾代替棉手帕 D.环保袋代替一次性塑料袋
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饱和FeCl3溶液滴入沸水中并煮沸1~2分钟,光束通过该分散系时,可观察到丁达尔效应,则该分散系是
A. 溶液 B. 乳浊液 C. 胶体 D. 悬浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中,符合右图所示关系的是( )

A. 一定状况下,气体摩尔体积(Y)与该气体的物质的量(X)的关系
B. 在光照情况下,一定体积的饱和氯水的pH(Y)随时间(X)的关系
C. 100℃,1个大气压下,按体积比1∶1混合的CO2和H2O(g)混合气通过足量Na2O2粉末,固体增加的质量(Y)与混合气体积(X)的关系
D. 向AlCl3溶液中滴加NaOH溶液至过量,生成Al(OH)3 的物质的量(Y)与消耗NaOH的物质的量(X)的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的恒容容器中,充入1molA和3molB,并在一定条件下发生如下反应:A(g)+3B(g)![]() 2C(g);经3s后达到平衡,测得C气体的浓度为0.6mol﹒L-1,下列说法中正确的组合是
2C(g);经3s后达到平衡,测得C气体的浓度为0.6mol﹒L-1,下列说法中正确的组合是
①用A表示反应的速率为0.1 mol﹒L-1﹒s-1
②用B表示反应速率为0.4 mol﹒L-1﹒s-1
③3s时生成C的物质的量为1.2mol
④3s时B的浓度为0.6mol﹒L-1
A.①②④ B.①③④ C.③④ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知常温下,Ksp[Fe(OH)3]=4.0×10-38, 在FeCl3溶液中加入NaHCO3溶液产生沉淀和气体,反应的离子方程式为:____________;若将所得悬浊液的pH调整为4,则溶液中Fe3+浓度为_________molL-1
(2)常温下,浓度均为0.1molL-1的下列五种钠盐溶液的PH如下表
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
PH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
上述盐溶液中的阴离子,结合H+能力最强的是__________。根据表中数据,浓度均为0.01 molL-1的下列四种酸的溶液分别稀释100倍,PH变化最大的是___________(填编号)。
A.HCN B.HClO C.CH3COOH D.H2CO3
(3) 下列说法不正确的是___ ___ ___ (填序号)
A.某温度下纯水中的c(H+)=10-6,故显酸性
B.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
C.相同温度下,0.1mol/LNH4Cl溶液中NH4+的浓度比0.1mol/L氨水中NH4+的浓度大
D.相同温度下,PH均为8的Na2CO3和NaHCO3溶液,前者物质的量浓度大
E.向饱和石灰水中加入CaO固体,溶液中Ca2+、OH-的物质的量均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4,4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-)是一种新型的自来水处理剂,它的性质和作用是( )
A.有强氧化性,可消毒杀菌,还原产物能吸附水中杂质
B.有强还原性,可消毒杀菌,氧化产物能吸附水中杂质
C.有强氧化性,能吸附水中杂质,还原产物能消毒杀菌
D.有强还原性,能吸附水中杂质,氧化产物能消毒杀菌
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com