
| OH- | CO | Cl- | NO | |
| Na+ | 溶 | 溶 | 溶 | 溶 |
| Ca2+ | 微 | 不 | 溶 | 溶 |
| Ba2+ | 溶 | 不 | 溶 | 溶 |
| Mg2+ | 不 | 微 | 溶 | 溶 |


科目:高中化学 来源: 题型:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀 | 1.3 | 3.3 | 7.5 | 10.3 |
| 完全沉淀 | 2.8 | 5.2 | 9.7 | 12.2 |
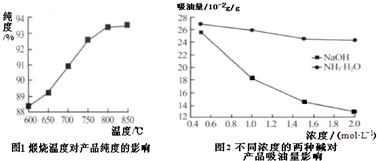
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、z=4 | ||
| B、B物质的转化率是20% | ||
| C、A的平衡浓度是1.6 mol/L | ||
D、平衡时气体压强是原来的
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某氢化物的溶液能使石蕊试液变蓝,该氢化物一定是氨气 |
| B、将某气体通入品红溶液中,品红溶液褪色,该气体一定是SO2 |
| C、配制硫酸亚铁溶液时应将硫酸亚铁固体溶于浓硫酸中,再稀释至所需浓度,以防止水解 |
| D、配制银氨溶液应将稀氨水逐滴滴入到硝酸银溶液中至产生的沉淀刚好溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
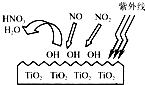 还原剂还原法、光催化氧化法、电化学吸收法是减少氮氧化物排放的有效措施.
还原剂还原法、光催化氧化法、电化学吸收法是减少氮氧化物排放的有效措施.查看答案和解析>>
科目:高中化学 来源: 题型:
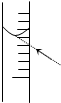 用18.4mol?L-1的浓H2SO4配制100mL浓度为1mol?L-1 H2SO4,其操作可分为以下几步:
用18.4mol?L-1的浓H2SO4配制100mL浓度为1mol?L-1 H2SO4,其操作可分为以下几步:查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 现象或事实 | 解释 |
A | 用浸有酸性高锰酸钾溶液的硅藻 土作水果保鲜剂 | 酸性高锰酸钾溶液能氧化水果释放的催熟剂乙烯 |
| B | 用氢氟酸蚀刻玻璃 | Si02是碱性氧化物,能溶于酸 |
| C | 过氧化钠作呼吸面具中的供氧剂 | 过氧化钠是强氧化剂,能氧化二氧化碳 |
| D | Al(OH)3用作塑料的阻燃剂 | Al(OH)3受热熔化放出大量的热 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com