
【题目】下列关于晶体的说法一定正确的是

A. 分子晶体中都存在共价键
B. CaTiO3晶体中每个Ti4+和12个O2-相紧邻
C. 在晶体中只要有阳离子就一定有阴离子
D. 晶格能:NaI>NaBr>NaCl>NaF
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】为了探究铁、铜及其化合物的性质,某同学设计并进行了下列实验。
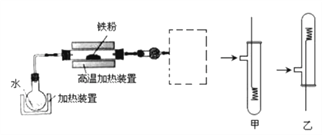
已知: 3Fe(s)+4H2O(g) ![]() Fe3O4(s)+4H2(g)
Fe3O4(s)+4H2(g)
请回答:
(1) 虚线框处宜选择的装置是_____ (填“甲”或“乙”); 实验时应将螺旋状铜丝加热,变黑后再趁热迅速伸入所制得的纯净氢气中,观察到的实验现象是_________。
(2)实验后,取硬质玻璃管中适量的固体,用一定浓度的盐酸溶解,滴加KSCN溶液,没有出现血红色,说明该固体中没有+3价的铁,判断结论是否正确并说明理由_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发射“神舟七号”载人飞船的是我国自行研制的“长征一号D”运载火箭。该火箭的主要燃料是偏二甲肼(用R表示)和四氧化二氮,在火箭发射时,两者剧烈反应产生大量气体并释放出大量的热,该反应的化学方程式为:![]() ,下列叙述错误的是( )
,下列叙述错误的是( )
A. 此反应是氧化还原反应
B. 反应瞬间产生大量高温气体,推动火箭飞行
C. 在此反应中![]() 作还原剂
作还原剂
D. R的分子式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关试剂保存的说法中,不正确的是( )
A.新制氯水保存在棕色试剂瓶中
B.金属Na保存在煤油中
C.漂白粉保存在敞口容器中
D.过氧化钠应密封保存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法错误的是( )
A.生活中常用的玻璃、水泥和陶瓷材料均需用石灰石作工业原料生产
B.胃舒平(主要成分:氢氧化铝)可用于胃酸中和剂
C.铝合金大量用于高铁建设
D.高纯硅可用于制作光感电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是世界上最大的钨储藏国,金属钨可用于制造灯丝、合金钢和光学仪器,有“光明使者”的美誉;现以白钨矿(主要成分为CaWO4,还含有二氧化硅、氧化铁等杂质)为原料冶炼高纯度金属钨,工业流程如下:

已知:①钨酸酸性很弱,难溶于水;
②完全沉淀离子的pH值:SiO32-为8,WO42-为5;
③碳和金属钨在高温下会反应生成碳化钨。
回答下列问题:
(1)工业上生产纯碱常先制得碳酸氢钠,此法叫“联碱法”,为我国化工专家侯德榜创立,即向饱和食盐水中先通入NH3,再通入CO2,最终生成碳酸氢钠晶体和氯化铵溶液,写出该化学反应方程式:____________。
(2)流程中白钨矿CaWO4和纯碱发生的化学反应方程式是:________________________。
(3)滤渣B的主要成分是(写化学式)______。调节pH可选用的试剂是:_____(填选项)。
A.氨水 B.盐酸 C.NaOH溶液 D.Na2CO3溶液
(4)检验沉淀C是否洗涤干净的操作是________________________________________。
(5)为了获得可以拉制灯丝的高纯度金属钨,不宜用碳而必须用氢气作还原剂的原因是_________。
(6)将氢氧化钙加入钨酸钠碱性溶液中可得到钨酸钙,已知某温度时,Ksp(CaWO4)=1×10-10,Ksp[Ca(OH)2]=4×10-7,当溶液中WO42-恰好沉淀完全(离子浓度等于10-5mol/L)时,溶液中c(OH-)=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲胺铅碘(CH3NH3PbI3)可用作全固态钙钛矿敏化太阳能电池的敏化剂,由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
共价键 | C—O | H—O | N—H | C—N |
键能/(kJ/mol) | 351.5 | 463 | 393 | 293 |
则该反应的ΔH=________kJ/mol。
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g) ![]() CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:

①下列说法不能判断该反应达到化学平衡状态的是________。
A.体系中气体的密度保持不变
B.CO的消耗速率与CH3OH的消耗速率相等
C.体系中CO的转化率和H2的转化率相等
D.体系中CH3OH的体积分数保持不变
②平衡时,M点CH3OH的体积分数为10%,则CO的转化率为________。
③某同学认为上图中Y轴表示温度,你认为他判断的理由是______________________。
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,同时生成I2,写出发生的化学反应方程式__________________。
(4)HI的制备:将0.8molI2(g)和1.2molH2(g)置于某1L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)![]() 2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7/span> |
HI体积分数 | 26% | 42% | 52% | 57% | 60% | 60% | 60% |
①该反应的平衡常数K=_____________。
②反应达到平衡后,在7min时将容器体积压缩为原来的一半,请在图中画出c(HI)随时间变化的曲线_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近日,中国科学家研发了一种碳修饰的镍基催化剂,实现了木质素选择性氢解得到酚类化合物。请回答下列问题:
(1)基态碳原子的核外电子有____种运动状态, 基态Ni原子的核外电子排布式为_________________。
(2)C、N、O三种元素的第一电离能由大到小的顺序为______________________。
(3)图1所示化合物中碳原子的杂化方式为_________,存在的化学键类型有_________(填标号)。

A.共价键 B.离子键 C.配位键 D.金属键 E.氢键
(4)碳的氧化物CO常作为许多金属配合物的配体,CO与N2互为等电子体,则CO分子中σ键与π键的个数比为______;测得熔点为170℃,预测属于___________晶体。
(5)一种储氢材料由镍、 镁元素组成,其晶胞结构如图2所示,则该晶体的化学式为__________,其晶胞边长为apm,列式计算晶胞密度为___________g/cm3 (不必计算出结果,阿伏加德岁常数的值为NA)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是( )
A. NH4Cl+NaOH=NaCl+NH3![]() +H2O B. Mg3N2+6H2O=3Mg(OH)2+2NH3
+H2O B. Mg3N2+6H2O=3Mg(OH)2+2NH3![]()
C. Cl2+2NaOH=NaClO+NaCl+H2O D. 2Na2O2+2H2O=NaOH+O2![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com