
【题目】下列有关试剂保存的说法中,不正确的是( )
A.新制氯水保存在棕色试剂瓶中
B.金属Na保存在煤油中
C.漂白粉保存在敞口容器中
D.过氧化钠应密封保存
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】I. 如下图所示,50mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1NaOH溶液在装置中进行中和反应。通过测定反应过程中所放出的热量,可计算中和热,回答下列问题:
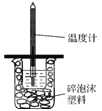
(1)图中装置缺少的仪器是 _______________。
(2)下列说法不正确的是________________ (填序号)。
A.若用50mL 0.55mol·L-1Ba(OH)2溶液代替NaOH溶液进行实验,测得的中和热相同
B.若用50mL 0.50mol·L-1醋酸溶液代替盐酸进行实验,测得的中和热相同
C.若分别用等浓度的硫酸和Ba(OH)2溶液代替盐酸和NaOH溶液进行实验,测得的中和热相同
D.NaOH溶液稍过量的原因是让盐酸完全反应
II.某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞;
B.用标准溶液润洗滴定管2-3次;
C.把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液;
D.取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm;
E.调节液面至0或0刻度以下,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度。完成以下填空:
(1)正确操作的顺序是(用序号字母填写)___________________.
(2)实验中眼睛注视_____________,直至滴定终点。判断到达终点的现象是___________。
(3)若三次实验所用KOH溶液体积分别为14.98 mL,16.80 mL,15.02 mL,则c(HCl)=______。
(4)下列操作中,可能造成测定结果偏高的是________________。
A. 未用标准液润洗碱式滴定管
B. 滴定终点读数时,俯视滴定管中液面刻度,其它操作均正确
C. 盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SiO2广泛存在自然界中,其用途也非常广泛,可用于制造光导纤维,也用于生产半导体材料硅。
(1)写出工业上制备粗硅的化学反应方程式_________________。
(2)SiO2耐腐蚀,但易溶于氢氟酸,写出化学反应方程式: ______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质的溶液 ①CH3COOH ②HCl ③H2SO4 ④NaHSO4
(1)若四种溶液的物质的量浓度相同,其c(H+)最大的是________(用序号表示,下同)。
(2)若四种溶液的c(H+)相同,其物质的量浓度最大的是________。
(3)将pH相同的上述四种溶液与Zn反应生成等量氢气,所需时间最短的是_________。
(4)将6 g CH3COOH溶于水制成1 L溶液,此溶液的物质的量浓度为________,经测定溶液中c(CH3COO-)为1.4×10-3 mol·L-1,此温度下醋酸的电离常数Ka=________,(写出计算式,不必计算最终结果)。温度升高,Ka将______(填“变大”、“不变”或“变小”)。
(5)在常温下将pH=11的NaOH溶液a L与pH=2的H2SO4溶液b L混合,若混合后溶液呈中性,则a:b=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于晶体的说法一定正确的是

A. 分子晶体中都存在共价键
B. CaTiO3晶体中每个Ti4+和12个O2-相紧邻
C. 在晶体中只要有阳离子就一定有阴离子
D. 晶格能:NaI>NaBr>NaCl>NaF
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为分析某盐的成分, 做了如下实验:
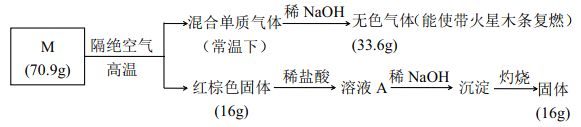
请回答:
(1)盐 M 的化学式是_________;
(2)被 NaOH 吸收的气体的电子式____________;
(3)向溶液 A 中通入H2S 气体, 有淡黄色沉淀产生, 写出反应的离子方程式________ (不考虑空气的影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)是无色、有强还原性的液体,实验室制各水合肼的原理为:CO(NH2)2+2NaOH+NaC1O=Na2CO3+N2H4·H2O+NaCl 据此,某学生设计了下列实验。
步骤1:制备NaC1O溶液。已知:3NaC1O![]() NaC1+NaC1O3
NaC1+NaC1O3

(1)用烧碱固体配制30%NaOH溶液时,所需玻璃仪器除量筒外还有_______(填字母)。
A.容量瓶 B.烧杯 C.移液管 D.玻璃棒
(2)装置A中发生反应的离子方程式是__________;若装置C中出现堵塞,玻璃管a中的现象为_______________;B中用冰水浴控制温度在30℃以下,其主要目的是______________。
步骤2:制取水合肼。
控制反应温度,将分液漏斗中的溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。(已知:N2H4·H2O+2NaC1O=N2↑+3H2O+2NaC1)。
(3)分液漏斗中的溶液是___________(填“A”或“B”);
A.NaOH和NaC1O混合溶液 B.CO(NH2)2溶液

步骤3:肼的性质分析与测定。
(4)水合肼与氨水性质相似,属于二元弱碱。水合肼与盐酸反应产生的正盐化学式为_______________。
(5)水合肼具有还原性,被氧化生成氮气。称取馏分0.3000g,加水配成加20.00mL溶液,一定条件下用0.1500 mol/L的I2溶液滴定。
①水合肼与碘溶液反应的化学方程式为_______________________________________;
②实验测得消耗I2溶液的平均值为20.00mL,馏分中N2H4·H2O的质量分数为__________。(保留三位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com