
【题目】(1)硫酸在下列用途或反应中各表现的性质是(用字母填在横线上)
A.难挥发性 B.酸性 C.吸水性 D.脱水性 E.强氧化性 F.催化作用
①敞口放置浓硫酸时,质量增加 _______,
②浓硫酸使润湿蓝色石蕊试纸先变红后又变黑___________,
③浓硫酸与铜反应_____________;
(2)氮氧化物也是造成酸雨的成分之一,治理汽车尾气中NO和CO的一种方法是:在汽车的排气管上装一个催化转换装置,使NO和CO反应,生成无毒气体,反应的化学方程式是_________________________________________;
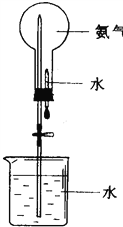
(3)喷泉是一种常见的自然现象,其产生的原因是存在压强差;提供如图的装置,请说明引发喷泉的方法____________________________________;
(4)为了测定某铜银合金的成分,将17.2 g合金溶于40 mL 12.25 mol/L的浓硝酸中,待合金完全溶解后,收集到3.36 L(标准状况下)气体(气体为NO和NO2混合气体),并测得溶液中c(H+)=1mol/L,假设反应后溶液的体积仍为40 mL,则合金中铜的质量分数为_______________( 保留两位有效数字),收集到的混合气体中NO与NO2的体积之比为___________。
【答案】 C BD BE 2 NO + 2CO = N2 + 2CO2 打开橡皮管的夹子,轻轻挤压滴管,使少量水进入烧瓶 37.21℅ 1﹕1
【解析】分析:(1)根据硫酸的酸性以及浓硫酸的特性分析判断;
(2)根据原子守恒可知无毒气体是氮气和二氧化碳,据此书写方程式;
(3)喷泉实验利用的原理是压强差;
(4)令混合物中Cu、Ag物质的量分别为xmol、ymol,根据合金质量及N原子守恒列方程,再根据m=nM计算铜的质量,进而计算质量分数;令混合气体中NO和NO2的物质的量分别为amol、bmol,根据二者体积及电子转移守恒列方程计算,进而计算一氧化氮和二氧化氮的体积。
详解:(1)①浓硫酸具有吸水性,因此敞口放置浓硫酸时,质量会增加,答案选C;
②硫酸具有酸性,同时浓硫酸还具有脱水性,所以浓硫酸可使润湿蓝色石蕊试纸先变红后又变黑,答案选BD;
③浓硫酸与铜反应生成硫酸铜、二氧化硫和水,体现浓硫酸的酸性和强氧化性,答案选BE;
(2)在汽车的排气管上装一个催化转换装置,使NO和CO反应,生成无毒气体,生成物是氮气和二氧化碳,因此反应的化学方程式是2NO+2CO=N2+2CO2;
(3)氨气是一种极易溶于水的气体,将胶头滴管中的水挤入烧瓶中,瓶内压强减小,在外界气压的作用下,水被压到瓶内,形成喷泉现象,因此方法是打开橡皮管的夹子,轻轻挤压滴管,使少量水进入烧瓶;
(4)收集到的气体为NO2和NO,故被还原的n(HNO3)=n(NO2+NO)=3.36L÷22.4Lmol-1=0.15mol;反应的n(HNO3)=12.25 molL-1×0.04L-1.0 molL-1×0.04L=0.45mol。设合金中铜、银物质的量分别为xmol、ymol,则:64x+108y=17.2,产物Cu(NO3)2、AgNO3中含NO3-物质的量各为2x mol、y mol,据N守恒可得:2x+y+0.15=0.45,联立解得x=0.1、y=0.10,故合金中铜的质量=0.10 mol×64g/mol=6.4g,合金中铜的质量分数为:6.4g/17.2g×100%=37.21%;令混合气体中NO和NO2的物质的量分别为amol、bmol,根据二者体积及电子转移守恒,则:a+b=0.15、3a+b=0.1×2+0.1×1=0.3,解得a=b=0.075,故收集到的混合气体中NO与NO2的体积之比为1﹕1。


科目:高中化学 来源: 题型:
【题目】如图所示的装置中,M为活动性顺序表中位于氢之前的金属,N为石墨棒,关于此装置的下列叙述中,不正确的是( )

A. 导线中有电流通过,电流方向是由N到M
B. N上有气体放出
C. M为正极,N为负极
D. M极上发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 标准状况下,5.6L.Cl2与足量NaOH反应转移的电子数为0.25NA
B. 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C. 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成56gN2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成56gN2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.元素周期表的一部分如下表所示,参照元素①~⑩在表中的位置,请回答下列问题:

(1)⑨的阴离子结构示意图为_____________________;③的简单氢化物与⑨的最高价氧化物对应的水化物化合生成的正盐的化学式为______________________。
(2)⑤和⑥形成的化合物的电子式为________________________。
(3)③、⑧的最高价氧化物对应水化物的酸性由强到弱的顺序为___________(用化学式表示,下同)>_________________________。
II.某同学欲利用下图装置验证同周期或同主族元素性质递变规律。

(4)干燥管D的作用是_________________________________________。
(5)证明非金属性:Cl>I。在A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液变蓝,则C试管中发生反应的离子方程式为_________________________________________。从环境保护的观点考虑,此装置的缺点是_____________________________________________________。
(6)证明非金属性:N>C,在A中加稀硝酸,B中加碳酸钙,C中加澄清石灰水;观察到C中溶液变浑浊的现象,该实验设计的原理是利用____________来比较元素非金属性的强弱。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某强氧化剂[RO(OH)2]2+离子2.4×10-3mol被亚硫酸钠还原到较低价态,需12mL0.2mol/L的亚硫酸钠溶液,则反应后R的化合价为
A.0 B.+2 C.+3 D.+4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡常温下是无色液体,在空气中极易水解,熔点-36℃,沸点114℃,金属锡的熔点为231℃。分液漏斗中放浓盐酸,仪器a中放MnO2,二者用于制氯气,用熔融的金属锡跟干燥的氯气直接作用制取无水四氯化锡(此反应过程放出大量的热)。请回答下列各问题。
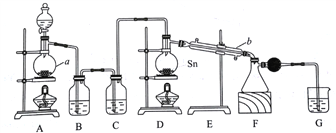
(1)仪器a、b的名称分别是______、________,仪器b的作用是__________________。
(2)图中装置F与装置G之间连接干燥管的目的是______________________________。
(3)装置D中Sn发生反应的化学方程式为___________;装 置 G 的作用是____________。
(4)装置B中的试剂是______________________;装置C的作用是_________________。
(5)实验过程中。当观察到________时,即可熄灭装置D处的酒精灯。
(6)已知四氯化锡遇水强烈水解,产物之一是固态二氧化锡,请写出四氯化锡水解的化学方程式______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将pH=3 的硫酸与pH=9的NaOH 溶液混合,若要得到pH=7 的溶液,混合时硫酸酸与NaOH溶液的体积比为( )
A.1:200
B.200:1
C.100:1
D.1:100
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32﹣、SO42﹣、NO3﹣中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( ) 
A.溶液中的阳离子只有H+、Mg2+、Al3+可能含有Fe3+
B.溶液中一定不含CO32﹣和NO3﹣ , 一定含有SO42﹣
C.溶液中c(NH4+)=0.3 mol/L
D.c(H+):c(Al3+):c(Mg2+)=1:1:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com