
【题目】常温下,将11.65gBaSO4粉末置于盛有250mL蒸馏水的烧杯中,然后向烧杯中加入Na2CO3固体(忽视溶液体积的变化)并充分搅拌,加入Na2CO3固体的过程中,溶液中几种离子的浓度变化曲线如图所示,下列说法中正确的是
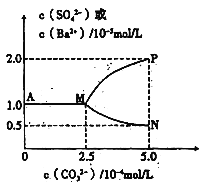
A. 相同温度时,Ksp(BaSO4)>Ksp(BaCO3)
B. BaSO4在水中的溶解度、Ksp均比在BaCl2溶液中的大
C. 若使0.05molBaSO4全部转化为BaCO3,至少要加入1.25molNa2CO3
D. 0.05molBaSO4恰好全部转化为BaCO3时,溶液中离子浓度大小为:c(CO32-)>c(SO42-)>c(Ba2+)
 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
【题目】生活中处处有化学。请根据你所学过的化学知识,判断下列说法中错误的是
A. 医疗上常用体积分数为70%-75%的酒精作消毒剂
B. 为防止流感传染,可将教室门窗关闭后,用食醋熏蒸,进行消毒
C. 海鲜、肉类等食品用福尔马林(甲醛溶液)浸泡防腐保鲜
D. 碘沾在手上立即用酒精洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列有关叙述错误的是
A. 80gCuO和Cu2S的混合物中,所含铜原子数为NA
B. 1molNaBH4与足量水反应(NaBH4+H2O=NaBO2+H2↑)时转移的电子数为:4NA
C. pH=13的Ba(OH)2溶液中,含有OH-0.2NA个
D. 密闭容器中PCl3与Cl2反应生成molPCl5(g),增加2A个P-C1键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将20.0 g 14%的NaCl溶液与30.0 g 24%的NaCl溶液混合,混合后得到密度为 1.17 g·cm-3的溶液。请计算:
(1)混合后的溶液中NaCl的质量分数是多少?___________
(2)混合后的溶液的物质的量浓度为多少?_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氧化还原反应3S+6KOH=K2SO3+2K2S+3H2O中,被氧化与被还原的硫原子数之比为( )
A.1:1
B.2:1
C.1:2
D.3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向某Na2CO3溶液中加入稀盐酸,溶液中含碳微粒的物质的量分数(φ)随溶液pH变化的部分情况如图所示。下列说法中正确的是
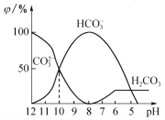
A. Na2CO3溶液中c(Na+)=c(CO32-)+ c(HCO3-)+ c(H2CO3)
B. pH=8时,溶液中c(Cl-)=c(Na+)
C. pH =7时,溶液中的c(Na+)>c(Cl-)>c(HCO3-)>c(H+)=c(OH-)
D. 25℃时,CO32-+H2O![]() HCO3-+OH-的Kh=10-10mol·L-1
HCO3-+OH-的Kh=10-10mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇的沸点是78℃,能与水以任意比混溶。乙醚的沸点为34.6℃,难溶于水,在饱和Na2CO3 溶液中几乎不溶,乙醚极易燃烧。实验室制醚的反应原理是:
2CH3CH2OH→H2O + CH3CH2—O—CH2CH3 (乙醚)
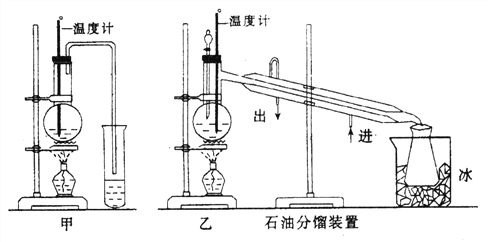
(1)甲图和乙图是两套实验室制乙醚的装置,选装置_________(填“甲”或“乙”)最合理,理由是______________________________。
(2)反应液中应加入沸石,其作用是____________________。
(3)反应中温度计的正确位置是水银球置于____________________。
(4)用装置乙制得的乙醚中可能含有大量的杂质,该杂质是__________,除去这种杂质的简易方法是__________________(提示:乙醚不溶于水,乙醇与水互溶)。
(5)如果温度太高,将会发生副反应,其产物名称为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com