
【题目】胶体的本质征是( )
A.丁达尔效应B.电泳现象C.粒子直径1-100nmD.布朗运动
科目:高中化学 来源: 题型:
【题目】下图示细胞中各种化合物或主要元素占细胞鲜重的含量,以下按①②③④顺序排列,正确的是

A. 水、蛋白质、糖类、脂质;N、H、0、C
B. 蛋白质、糖类、脂质、水;0、C. N、H
C. 水、蛋白质、脂质、糖类;H、0、C.N
D. 蛋白质、水、脂质、糖类;C.0、H、N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氧化还原反应KClO3 + 6HCl = KCl + 3Cl2↑+ 3H2O中,当生成0.5 mol Cl2时,氧化产物和还原产物的物质的量之比为( )
A.5:1B.3:1C.1:3D.1:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Br2+2Fe2+===2Fe3++2Br-。向100mLFeBr2溶液中通入标况下氯气6.72L,氯气全部被还原,测得溶液c(Br-)=c(Cl-),原溶液中FeBr2溶液的浓度(mol·L-1)为( )
A. 2 B. 4 C. 2.5 D. 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰及其化合物在生产、生活中有许多用途。在实验室中模拟工业利用软锰矿(主要成分为MnO2,含少量SiO2、Fe2O3和Al2O3等)制备金属锰等物质,设计流程如下:

己知:Mn2+有较强的还原性,在空气中能被氧气氧化,碳酸锰在空气中高温加热固体产物为Mn2O3;部分氢氧化物的Ksp(近似值)如下表。
物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
Ksp | 10-13 | 10-17 | 10-39 | 10-33 |
(1)“酸浸”前需将软锰矿粉碎的目的是_____________;酸浸过程MnO2发生反应的离子方程式为_________________。
(2)向滤液I中需先加A物质,再加B物质,若加入的物质均为非金属化合物的溶液,则A为(填物质的名称)_________,B为(填物质的名称)________。滤渣II的成分是_______(填物质的化学式)。
(3)“酸浸”需适宜的酸浓度、液固比、酸浸温度等,其中浸取率随酸浸时间的变化如图所示:

当浸取时间超过4h时,锰浸取率反而减小,其原因是______________。
(4)测得滤液I中c(Mn2+)=0.1mo/L,则加入B调节溶液pH范围为______。(已知:当某种离子浓度小于1×10-5mo/L时,可认为其沉淀完全。结果保留两位小数)
(5)“沉锰”过程中加入氨水的目的是(从化学平衡移动的角度解释)______________。
(6)写出由MnCO3为原料制备金属锰的过程中所涉及的化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一-选修3:物质结构与性质]由S、Cl 及Fe、Co、Ni 等过渡元素组成的新型材料有着广泛的用途,回答下列问题:
(1)钴元素基态原子的电子排布式为________,P、S、Cl的第一电离能由大到小顺序为______。
(2)SCl2 分子中的中心原子杂化轨道类型是______,该分子空间构型为_______。
(3)Fe、Co、Ni等过渡元素易与CO形成配合物,化学式遵循18电子规则:中心原子的价电子数加上配体提供的电子数之和等于18,如Ni 与CO形成配合物化学式为Ni(CO)4,则Fe与CO形成配合物化学式为_______。Ni(CO)4中σ键与π键个数比为_______,Ni(CO)4为____晶 体。
(4)已知NiO的晶体结构如图1所示。
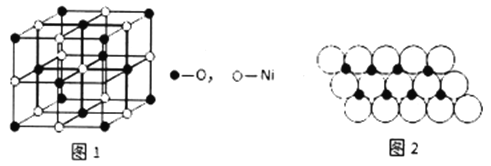
①NiO的晶体结构可描述为:氧原子位于面心和顶点,氧原子可形成正八面体空隙和正四面体空隙,镍原子填充在氧原子形成的空隙中。则NiO 晶体中镍原子填充在氧原子形成的______体空隙中。
②已知MgO 与NiO的晶体结构相同,其中Mg2+和Ni2+的离子半径分别为66pm 和69pm。则熔点:MgO_____ NiO( 填“ >”、“ <" 或“ =” ), 理由是______________。
③一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充O2-形成的正三角形空隙中(如图2),已知O2-的半径为am,每平方米面积上分散的NiO的质量为_________g。(用a、NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:(用于沉淀的试剂稍过量)

(1)第①步中,操作A是________,第⑤步中,操作B是________。
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)______________。
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是__________。
(4)判断BaCl2已过量的方法是____________________________________。
(5)下列是某学生设计操作A后混合液中Cl-、SO42-的检验步骤请根据内容填空:
①首先检验_____离子,应先加入过量的_____________________。
②将所得混合物______(填操作名称),然后在溶液中加入试剂________检验另一离子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com