
【题目】下列热化学方程式书写正确的是(![]() 的绝对值均正确)
的绝对值均正确)
A.C2H5OH(l)+3O2(g)= 2CO2(g)+3H2O(g) △H= -1367.0 kJ/mol(燃烧热)
B.S(s)+O2(g)= SO2(g) △H= -269.8kJ/mol(反应热)
C.NaOH(aq)+HCl(aq)= NaCl(aq)+H2O(l) △H= +57.3kJ/mol(中和热)
D.2NO2 = O2+2NO △H= +116.2kJ/mol(反应热)
科目:高中化学 来源: 题型:
【题目】已知次氯酸是比碳酸还弱的酸,反应Cl2+H2O=HCl+HClO达到平衡后,要使HClO浓度增大,可加入( )
A.NaCl固体B.水C.CaCO3固体D.NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家积极探索新技术对CO2进行综合利用。
Ⅰ.CO2可用来合成低碳烯烃:2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g) △H=akJ/mol
CH2=CH2(g)+4H2O(g) △H=akJ/mol
请回答:

(1)已知:H2和CH2=CH的燃烧热分别是285.8kJ/mol和1411.0kJ/mol,且H2O(g)![]() H2O((1)△H=-44.0kJ/mol,则a=_____________kJ/mol。
H2O((1)△H=-44.0kJ/mol,则a=_____________kJ/mol。
(2)在体积为1L的恒容密闭容器中,充入3molH2和1molCO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图1所示。下列说法正确的是_____________。
A.平衡常数大小: KM < KN
B.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于点M1
C.图1中M点时,乙烯的体积分数为7.7%
D.当压强或n(H2)/n(CO2)不变时均可证明化学反应已达到平衡状态
(3)保持温度不变,在体积为V L的恒容容器中以n(H2)∶n(CO2)=3∶1的投料比加入反应物,t0时达到化学平衡。请在图2中作出容器内混合气体的平均相对分子质量![]() 随时间变化的图象。___________
随时间变化的图象。___________

Ⅱ.利用“Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示:

(4)放电时,正极的电极反应式为______。
(5)若生成的Na2CO3和C全部沉积在正极表面,当转移0.2mole-时,正极增加的质量为_______g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,向容积为2L的密闭容器中充入一定量的CH4和H2O,发生反应:
时,向容积为2L的密闭容器中充入一定量的CH4和H2O,发生反应:![]() ,
,![]() 时达到平衡状态,反应过程中测定的部分数据见下表
时达到平衡状态,反应过程中测定的部分数据见下表![]() 表中时间
表中时间![]() :
:
反应时间/min | n(H2O)/mol | n(CO)/mol |
0 | 2.00 | 0.00 |
t1 | 1.60 | |
t2 | 1.40 |
下列说法正确的是 ![]()
![]()
A.反应在![]() 内的平均速率为
内的平均速率为![]()
B.![]() 时,
时,![]()
C.![]() 时,
时,![]() 的转化率为
的转化率为![]()
D.保持其他条件不变,![]() 时
时![]() 向容器中再通入
向容器中再通入![]() ,正反应速率加快,逆反应速率减小
,正反应速率加快,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,在
时,在![]() 的密闭容器中充入
的密闭容器中充入![]() 和
和![]() ,一定条件下发生反应:
,一定条件下发生反应:![]() ,测得
,测得![]() 和
和![]() 的浓度随时间变化如下表所示。下列说法不正确的是
的浓度随时间变化如下表所示。下列说法不正确的是
时间 |
|
|
|
| 6 | 0 | ? |
| 3 | 1 |
|
A.![]() 时间内
时间内![]()
B.![]() 时,若升高温度或再充入
时,若升高温度或再充入![]() 气体,都可以提高
气体,都可以提高![]() 的转化率
的转化率
C.![]() 时,
时,![]() 正
正![]() 逆
逆![]()
D.![]() 时,平衡常数
时,平衡常数![]() ,
,![]() 与
与![]() 的转化率相等
的转化率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:N2(g)+3H2(g) ![]() 2NH3(g) △H = -92.2 kJ/mol。下列说法不正确的是
2NH3(g) △H = -92.2 kJ/mol。下列说法不正确的是
A.1 mol N2(g)和3 mol H2(g)的能量之和高于2 mol NH3 (g)的能量
B.形成2 mol NH3(g)的化学键释放的总能量大于断裂1 mol N2 (g) 和3 mol H2 (g) 的化学键所吸收的总能量
C.加入催化剂是为了加大反应速率,缩短生产周期,降低生产成本
D.将1 mol N2(g)和3 mol H2(g)充入一密闭容器中充分反应,放出92.2 kJ 的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中充有10molCO与20molH2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如图所示。下列说法正确的是( )
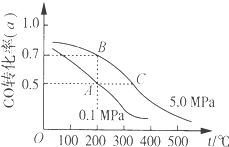
A.若A、B两点表示在某时刻达到的平衡状态,则A、B两点时容器内总气体的物质的量,n(A):n(B)=4:5
B.若A、C两点都表示已达到的平衡状态,则从反应开始至到达平衡状态所需的时间tA>tC
C.设B、C两点的平衡常数分别为KB、KC,则KB<KC
D.在不改变反应物用量的情况下,采取降温、减压或将甲醇从混合体系中分离出来均可提高CO的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知H-H键键能(断裂时吸收或生成时释放的能量)为436 kJ·mol-1,H-N键键能为391 kJ·mol-1,根据热化学方程式:N2(g) +3H2(g) =2NH3(g) ΔH=-92.4 kJ·mol-1。则N≡N键的键能是_________。
(2)已知下列热化学方程式:
①Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) △H=﹣25 kJ·mol-1
②3Fe2O3(s)+CO(g) = 2Fe3O4(s)+CO2(g) △H=﹣47 kJ·mol-1
③Fe3O4(s)+CO(g) = 3FeO(s)+CO2(g) △H=﹢19 kJ·mol-1
写出FeO(s)被CO还原成Fe和CO2的热化学方程式______________。
(3)氯化铁水解的离子方程式为__________ ,配制氯化铁溶液时滴加少量盐酸的作用是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】)次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)在印染、医药以及原子能工业中应用广泛。
以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
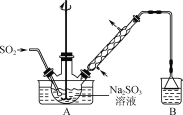
步骤1:在右图所示装置的烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH约为4,制得NaHSO3溶液。
步骤2:将装置A中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90 ℃下,反应约3 h,冷却至室温,抽滤。
步骤3:将滤液真空蒸发浓缩,冷却结晶。
(1) 装置B的烧杯中应加入的溶液是________。
(2) 步骤2中加入锌粉时有NaHSO2和Zn(OH)2生成。
①写出加入锌粉时发生反应的化学方程式:________。
②生成的Zn(OH)2会覆盖在锌粉表面阻止反应进行,防止该现象发生的措施是________。
(3) 冷凝管中回流的主要物质除H2O外,还有________(填化学式)。
(4) 步骤3中次硫酸氢钠甲醛不在敞口容器中蒸发浓缩的原因是________。
(5) 步骤2抽滤所得滤渣的成分为Zn和Zn(OH)2,利用滤渣制备ZnO的实验步骤为:将滤渣置于烧杯中,________________________________________________________,900 ℃煅烧。 (已知:① Zn能与NaOH发生反应Zn+2NaOH===Na2ZnO2+H2↑;② Zn2+开始沉淀的pH为5.9,沉淀完全的pH为8.9,pH>11时,Zn(OH)2能生成ZnO22-。实验中须使用的试剂有1.0 mol·L-1 NaOH溶液、1.0 mol·L-1 HCl溶液、水)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com